
| A. | 32% | B. | 24.2% | C. | 22.2% | D. | 16.7% |
分析 原KNO3溶液的质量分数等于溶质质量和溶液质量的比值,据此计算回答.
解答 解:t℃时的KNO3溶液的状态未明确,但是蒸发掉20g水,有4g晶体析出后剩余的溶液为饱和溶液,乙将溶液蒸发掉25g水后也冷却到20℃,析出5.6g晶体,即在5g水中溶解1.6g硝酸钾在t℃形成的是饱和溶液,t℃时KNO3饱和溶液中溶质的质量分数=$\frac{1.6g}{5g+1.6g}$×100%=24.24%,剩余的溶液为饱和溶液,其中溶质质量=(90g-20g-4g0)×24.24%=16g,原90g溶液中溶质的质量分数=$\frac{16g}{90g}$×100%≈17%.
故选D.
点评 这个题的关键是找出饱和溶液的关系式,即5克水和1.6克晶体组成的溶液是饱和溶液.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气可供人呼吸但会使食物变质 | |
| B. | 化肥能促进植物生长但会污染土壤 | |
| C. | 一氧化碳可用于冶炼金属但会使人中毒 | |
| D. | 二氧化碳能灭火但会造成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积0.1mol/L HCl和0.01mol/L HCl反应 | |
| B. | 等质量锌粒和镁粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等量1 mol/L碳酸钠溶液 | |
| D. | 等体积0.2 mol/HCl 和0.1 mol/L H2SO4 与等量等表面积的石灰反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa,20℃时48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
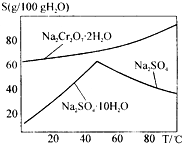 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含四种元素的原子半径由小到大的顺序为:H<O<N<C | |
| B. | 同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | |
| C. | 与足量烧碱溶液共热的离子方程式为:NH4++OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
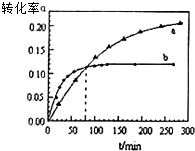 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com