
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| n |
| V |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 装置 |  | 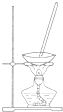 |  | 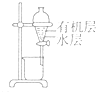 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换 |
| B、Na2O2中阴阳离子数数目之比为1:1 |
| C、Cl2与SO2均能使品红褪色,说明二者均有氧化性 |
| D、NO能够与人体里的血红蛋白结合,造成人体缺氧中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑥⑧ | B、③⑦⑧ |
| C、②⑤⑥⑦ | D、①④⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com