
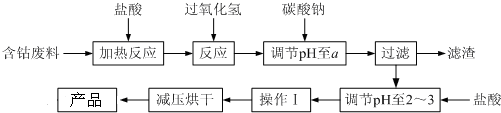
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
分析 含钴废料中加入盐酸,可得CoCl2、AlCl3、FeCl2,加入过氧化氢,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应空气温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,以此解答该题.
解答 解:含钴废料中加入盐酸,可得CoCl2、AlCl3、FeCl2,加入过氧化氢,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应空气温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)金属和盐酸反应生成氯化物,和硝酸反应生成硝酸盐,同时生成一氧化氮,导致氯化物中含有硝酸盐杂质,且生成有毒气体,污染环境,所以用盐酸代替硝酸可减小有毒气体的排放,防止产品中混有硝酸盐,
故答案为:减少氮氧化合物等有毒气体的排放,防止产品中混有硝酸盐;
(2)加入过氧化氢,可将将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:将Fe2+氧化成Fe3+;
(3)废料加入盐酸后生成氯化物,然后加入双氧水,二价铁离子被双氧水氧化生成三价铁离子,根据沉淀的PH值表格知,当溶液的PH值为5.2时,铁离子和铝离子被完全沉淀,当溶液的PH值为7.6时,钴离子才开始产生沉淀,所以要想将铁离子、铝离子和钴离子分离,溶液的pH值应该不小于5.2不大于7.6,
故答案为:5.2~7.6;
(4)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,
故答案为:蒸发浓缩、冷却结晶;
(5)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:样品中含有NaCl杂质(或烘干时失去了部分结晶水).
点评 本题综合考查物质的制备和提纯等知识,是一道综合性很强的实验探究题,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 物质在不电离的条件下,也能导电 | |
| B. | 若化学平衡向逆反应方向移动,则正反应速率不一定减小 | |
| C. | 硫酸钡、醋酸铵、碳酸氢钠都是强电解质 | |
| D. | 导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=4的NaHSO4溶液中,水电离出的c(H+)为1×10-10mol•L-1 | |
| B. | 向纯水中加入盐类物质,有可能促进水的电离,也有可能抑制水的电离 | |
| C. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① | |
| D. | 用0.1mol•L-1醋酸滴定0.1mol•L-1NaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com