

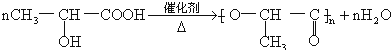
分析 海水晒盐后得到粗盐,淡水,粗盐提纯除去所含杂质Ca2+、Mg2+、SO42-及泥沙,得到精盐,电解制备氯气;
母液中主要是溴离子和镁离子,通入氯气氧化溴离子为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液中加入贝壳高温分解生成的氧化钙溶于水生成的氢氧化钙石灰乳,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁,
(1)加入过量的碳酸钠可除去Ca2+以及过量的Ba2+杂质;
(2)A.裂化汽油含有不饱和键;
B.萃取分液时防止液体重新混而污染;
C.在萃取过程中,需要防止分液漏斗内的压强过大;
(3)步骤I已经获得Br2浓度较低,应进行富集,;
(4)氯气、溴与水反应生成盐酸或HBr,为可逆反应,应抑制与水的反应;
(5)氢氧化镁的溶解度比氢氧化钙小,在溶液中加入氢氧化钙,可生成氢氧化镁沉淀;
(6)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(7)MgO熔点很高,电解熔融氧化镁需要消耗较高的能量,从而增加成本,工业上用电解熔融氯化镁冶炼Mg.
解答 解:海水晒盐后得到粗盐,淡水,粗盐提纯除去所含杂质Ca2+、Mg2+、SO42-及泥沙,得到精盐,电解制备氯气;
母液中主要是溴离子和镁离子,通入氯气氧化溴离子为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液中加入贝壳高温分解生成的氧化钙溶于水生成的氢氧化钙石灰乳,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁,
(1)Ca2+用碳酸钠转化为沉淀、Mg2+用NaOH转化为沉淀、SO42-用氯化钡溶液转化为沉淀,先除去Mg2+或SO42-,然后再加入过量的碳酸钠除去Ca2+以及过量的Ba2+杂质,过滤后再加盐酸除去过量的NaOH和碳酸钠,
故答案为:除去Ca2+、过量的Ba2+杂质;
(2)A.裂化汽油含有不饱和键,可与溴发生加成反应,不能用于萃取剂,故A错误;
B.萃取分液时下层液体从下口放出,上层液体从上口倒出,防止液体重新混而污染,故B正确;
C.在萃取过程中,需要振荡分液漏斗,以充分混合而萃取,并打开分液漏斗上口的玻璃塞放气,防止分液漏斗内的压强过大,故C正确;
故答案为:A;
(3)步骤I已经获得Br2浓度较低,应进行富集,与二氧化硫反应后得到浓度角度的溴化氢溶液,然后通入氯气可得到纯溴,起到浓缩、提纯溴元素的作用,
故答案为:富集溴;
(4)氯气、溴与水反应生成盐酸或HBr,为可逆反应,加入硫酸酸化,可抑制Cl2、Br2与水反应,故答案为:酸化可抑制Cl2、Br2与水反应;
(5)氢氧化镁的溶解度比氢氧化钙小,在溶液中加入氢氧化钙,可生成氢氧化镁沉淀,反应的离子方程式为Mg2+(aq)+Ca(OH) 2(s)=Ca 2+(aq)+Mg (OH) 2(s),
故答案为:Mg2+(aq)+Ca(OH) 2(s)=Ca 2+(aq)+Mg (OH) 2(s);因为在相同的温度下,Mg (OH)2的溶解度比Ca(OH)2更小;
(6)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气随水排出,溴蒸气中水增加,而温度过低,溴不能完全蒸出,吸收率低;
(7)MgO熔点很高,电解熔融氧化镁需要消耗较高的能量,从而增加成本,工业上用电解熔融氯化镁冶炼Mg,
故答案为:MgO熔点很高,熔融时耗能高,增加生产成本.
点评 本题以海水资源及其利用为载体综合考查物质的分离、制备,侧重于学生的分析、实验能力的考查,题目涉及金属的冶炼、物质的分离和提纯、氧化还原反应等知识点,能从总体上分析工艺流程图,知道每一步发生的反应或操作方法,熟悉常见物质的分离方法,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物有3种同分异构体(不考虑立体异构) | |
| B. | 汽油、煤油、柴油、甘油结构相似,性质相似 | |
| C. | -C(CH3)3的系统命名为1,1-二甲基乙基 | |
| D. | 聚乙烯塑料老化是因为发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu片、Ag | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
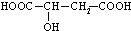 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸能使紫色的石蕊试液变红 | |
| B. | 苹果酸能发生酯化反应 | |
| C. |  与苹果酸是同一种物质 与苹果酸是同一种物质 | |
| D. | 1mol苹果酸在一定条件下可与2molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
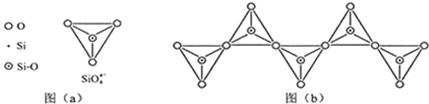
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
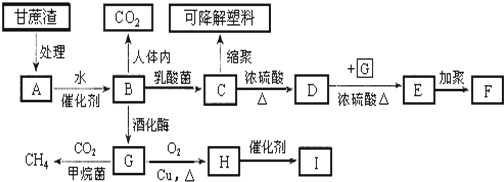
 ;六元环状化合物I
;六元环状化合物I .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
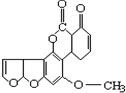
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com