
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过干馏等物理变化可以转化为清洁燃料 | |
| C. | 煎炸食物的花生油和牛油都属于酯类,属于高分子化合物 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
分析 A.聚乙烯不含碳碳双键;
B.干馏为煤隔绝空气下发生的复杂物理、化学变化;
C.花生油和牛油都属于酯类,为油脂,相对分子质量在10000以下;
D.淀粉水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇.
解答 解:A.聚乙烯不含碳碳双键,不能发生加成反应,则聚乙烯塑料的老化是由于长链断裂等原因,故A错误;
B.干馏为煤隔绝空气下发生的复杂物理、化学变化,属于化学变化,煤的气化、液化可转化为清洁能源,故B错误;
C.花生油和牛油都属于酯类,为油脂,相对分子质量在10000以下,不是高分子,故C错误;
D.淀粉水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇,则利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意煤的综合应用及有机反应,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳原子有四个价电子 | B. | 碳原子彼此可结合成长链 | ||
| C. | 组成有机物的元素种类很多 | D. | 有机物容易形成同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基的电子式为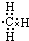 | |
| B. | 大量获得乙烯的工业方法是乙醇的消去反应 | |
| C. | C3H8只能表示一种物质 | |
| D. | 乙烷在光照的条件下与氯气混和,最多可以生成10种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素族序数一定等于它的最外层电子数 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
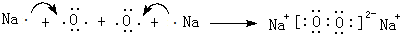 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
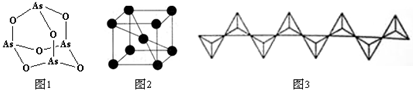
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com