
一般情况下,前者无法决定后者的是( )
A.原子核外电子排布——元素在周期表中的位置
B.化合物熔融状态是否导电——化合物是否为离子化合物
C.分子间作用力的大小——分子稳定性的强弱
D.物质内部储存的能量高低——化学反应的热效应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示,下列说法不正确的是

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48mL
C.原硝酸溶液中含硝酸的物质的量为0.5mol
D.样品中铝粉和铁粉的物质的量之比5:3
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:①乙醇在浓硫酸的存在下在l40℃脱水生成乙醚(CH3CH2OCH2CH3);②浓硫酸将乙醇脱水碳化。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入____________,其目的是吸收反应中可能生成的酸性气体:(填
正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是_____________________;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用_______________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
金属-硫电池价格低廉,使用寿命较长,能量密度高,因而在电池研究领域得到广泛关注。最近,我国科研工作者研究了一种能在室温下工作的新型Na-S电池。该电池放电过程的总反应方程式如下:nS + 2Na = Na2Sn
注:能量密度指单位质量的电极材料可输出的电能,以W·h·kg-1为计量单位。
则下列说法不正确的是( )
A.该电池中用固态金属Na为负极,S单质作为正极,但S单质须负载在导电材料上
B.该电池的电解质必须具备室温下传导Na+的能力,但不宜用NaOH溶液作为电解液
C.n值越大则该电池的能量密度越高
D.该电池充电过程中阳极的电极反应式:Na2Sn-2e-=2Na+ + nS,故充电时Na+从阳极向阴极迁移
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
研究化肥的合成、废水的处理等有现实的重要意义。
(1)工业生产中,以NH3为原料制硝酸,写出工业生产硝酸最后一步的化学方程式 。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:

已知:CO+H2O CO2+H2;
CO2+H2;
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。现有甲、乙、丙三家工厂生产原料如下:
甲厂以焦炭和水为原料;
乙厂以天然气和水为原料;
丙厂以石脑油(主要成分为C5H12)和水为原料。
请根据上述信息判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高:________(填“甲”、“乙”或“丙”)。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。

①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的铵态氮肥中SO42-所用试剂是_______________________。
(4)为减少环境污染,工业上也常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:选择题
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源:2016届湖南省株洲市高三上学期期中化学试卷(解析版) 题型:填空题
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是_____________________________________为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为__________。
(2)为了保护这些纸质文物,有人建议采取如下措施:喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷,生成的氧化锌可以防止酸性腐蚀。用该方法生成氧化锌的化学方程式为__________________。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
① FeTiO3+ C+ Cl2  TiCl4+ FeCl3+ CO
TiCl4+ FeCl3+ CO
② TiCl4+O2 TiO2+2Cl2
TiO2+2Cl2
(4)某新型“纸电池”以碳纳米管和金属锂为两极,造纸用的纤维素在一种离子液体M中溶解作隔离膜,电池工作时的总反应式为xLi+C(碳纳米管) LixC,下列有关说法正确的是
LixC,下列有关说法正确的是
A.放电时Li+由正极向负极移动
 B.充电池的阳极反应式为LixC-xe-= xLi++ C
B.充电池的阳极反应式为LixC-xe-= xLi++ C
C.M可能为羧酸、醇等含活泼氢的有机物
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 苯酚钠溶液中通入少量二氧化碳气体: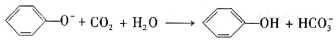
B. 金属铝溶于NaOH溶液:Al + 2OH- =AlO2- + H2↑
C. 澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-=CaCO3↓+ H2O
D. NaHCO3的水解:HCO3- + H2O H3O+ + CO32-
H3O+ + CO32-
查看答案和解析>>
科目:高中化学 来源:2016届辽宁抚顺第一中学高三上第一次模拟考试化学试卷(解析版) 题型:选择题
在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol/L的NaOH溶液中充分反应,放出xkJ热量。已知该条件下,1mol CO2通入到2L1.0mol/LNaOH溶液中充分反应,放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确为
A.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ/mol
B.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ/mol
C.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y)kJ/mol
D.CO2(g)+NaOH(aq)=2NaHCO3(aq)△H=-(8x-2y)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com