

| A. | 滤液A中的阳离子为Fe2+、Fe3、H+ | B. | 样品中金属Fe的质量为4.48g | ||
| C. | 样品中CuO的质量为4.0 | D. | V=448 |
分析 硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,利用极限法判断样品中CuO的质量问题;
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,硫酸含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
解答 解:A、氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,故A错误;
B.固体为三氧化二铁,其物质的量为$\frac{3.2g}{160g/mol}$=0.02mol,铁元素的量为0.02mol×2=0.04mol,n(Fe)=0.04mol×56g/mol=2.24g,金属Fe的质量小于2.24g,故B错误;
C.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,但是不能确定CuO的具体质量,故C错误;
D.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=$\frac{3.2g}{64g/mol}$=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量$\frac{5.76g-3.2g-2.24g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故D正确;
故选D.
点评 本题考查混合物计算,为高频考点,清楚反应过程是解答关键,侧重解题方法与分析解决问题能力的考查,注意利用极限法与原子守恒解答,难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加Fe粉的用量 | |
| B. | 充入Ar,保持容器内体积不变 | |
| C. | 保持容器体积不变,增加水蒸气输入量 | |
| D. | 充入Ar,保持容器内压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250mL | B. | 200 mL | C. | 100 mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH-CHO | B. | CH3-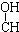 - -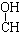 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-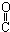 -CH2-CHO -CH2-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混有HCl的Cl2通入盛有饱和NaHCO3溶液的洗气瓶除去 | |
| B. | 实验室制取Cl2,浓盐酸起到酸性和还原剂的作用 | |
| C. | 用惰性电极电解饱和食盐水的离子方程式为2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 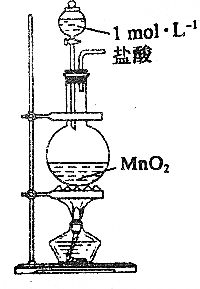 实验室可用图所示装置于制取少量Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
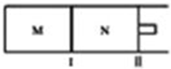 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<3,C的平衡浓度关系为:c(M)<c(N) | |
| C. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | |
| D. | x不论为何值,平衡时M、N中的平均相对分子质量都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(0H)2悬浊液不能鉴别麦芽糖和蔗糖 | |
| B. | 硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 | |
| C. | 油是不饱和高级脂肪酸的简单甘油酯,是纯净物 | |
| D. | 用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com