
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)![]() xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
请计算:(写出计算过程,无过程不给分)
(1)平衡时A的浓度;______反应开始前容器中B的物质的量;_____
(2)前5 min内用B表示的平均反应速率;______
(3)化学反应方程式中x的值;_____
(4)5min时物质A的转化率。____
【答案】0.75 3 0.05 2 50%
【解析】
(1)先根据D的浓度求出D的物质的量,再由方程式求出A、B的物质的量;
(2)先求出反应的B的物质的量,再根据平均反应速率公式计算B的平均反应速率;
(3)根据同一反应中反应速率之比等于化学计量数之比求出x值;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%.
(1)5分钟后,n(D)=CV=0.5mol·L-1×2L=1mol,设反应开始前放入容器中A、B物质的量为mmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
n前/mol m m 0 0
n后/mol( m-1.5)( m-0.5) 1
c(A):c(B)=3:5=( m-1.5):( m-0.5)
m=3 mol
此时A的浓度c(A)=(3-1.5)mol/2L=0.75mol·L-1;
(2)设反应的B的物质的量为nmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
1 2
nmol 1mol
n=0.5
根据v(B)=![]() =0.05 mol/(L.min)
=0.05 mol/(L.min)
(3)根据同一反应中反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L·min):0.1mol/(L·min)=1:x,所以x=2;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%=1.5/3×100%=50%.


科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)可与重金属盐产生沉淀,是目前应用较多的一种新型水处理剂。利用精钼矿![]() 主要成分是MoS2,含少量PbS等
主要成分是MoS2,含少量PbS等![]() 来制取钼酸钠晶体的工艺流程如下图所示。
来制取钼酸钠晶体的工艺流程如下图所示。
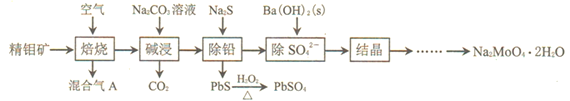
请回答下列问题:
⑴混合气A中含有一种大气污染物,其化学式为___________。
⑵焙烧的过程中采用如图1所示的“多层逆流焙烧”。

①多层逆流焙烧的优点是___________![]() 任答两点
任答两点![]() 。
。
②依据如图2,写出第6—12层MoO2参加反应的化学方程式___________。
⑶写出碱浸时发生反应的离子方程式___________。
⑷PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是___________。
⑸流程图中“除SO42-”的过程中,当BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L,Ksp(BaSO4) = 1.0×10-10,则Ksp(BaMoO4) = ___________。![]() 过程中溶液体积变化忽略不计
过程中溶液体积变化忽略不计![]()
⑹锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是___________。
Lix(MoS2)n,则电池放电时的正极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),则下列叙述中正确的是( )
4NO(g)+6H2O(g),则下列叙述中正确的是( )
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成nmolNO的同时,生成nmolNH3,则反应达到平衡状态
C.若NH3、O2、NO、H2O的分子数之比为4∶5∶4∶6时,反应达到化学平衡状态
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
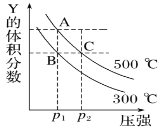
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、![]() 、NO、
、NO、![]() 是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
方案一:转化成无害气体.涉及的反应如下.
反应Ⅰ:![]()
反应Ⅱ:![]()
(1)反应![]() 的
的![]() ________
________![]() .
.
(2)一定条件下,将![]() 与CO以物质的量之比为
与CO以物质的量之比为![]() 置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
![]() 每消耗
每消耗![]() 的同时生成
的同时生成![]()
![]() 容器中混合气体密度保持不变
容器中混合气体密度保持不变
![]() 与CO的物质的量之比保持不变
与CO的物质的量之比保持不变
![]() 混合气体颜色保持不变
混合气体颜色保持不变
![]() 混合气体的平均相对分子质量保持不变
混合气体的平均相对分子质量保持不变
(3)向容积为2L的恒容密闭容器中分别充入![]() 和
和![]() ,发生反应
,发生反应
Ⅱ![]() 在不同温度下测定反应相同时间时
在不同温度下测定反应相同时间时![]() 的转化率
的转化率![]() ,结果如图所示.
,结果如图所示.
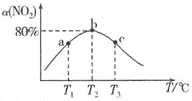
![]() 、c两点反应速率大小关系为
、c两点反应速率大小关系为![]() ________
________![]() 填或“
填或“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 温度为
温度为![]() 时,反应从开始经过
时,反应从开始经过![]() 达到b点,用
达到b点,用![]() 表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________
表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________![]() 若在此温度下,保持容器的容积不变,b点时再向容器中充入
若在此温度下,保持容器的容积不变,b点时再向容器中充入![]() 和
和![]() ,
,![]() 的平衡转化率将________
的平衡转化率将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
![]() 的转化率随温度升高先增大后减小的原因是________.
的转化率随温度升高先增大后减小的原因是________.
方案二:用次氯酸钠处理废水中的氨,使其转化为氮气除去.涉及的反应为![]() .
.
(4)上述反应中HClO来自次氯酸钠溶液,原理是________![]() 用离子方程式表示
用离子方程式表示![]() .
.
(5)实验测得废水pH与氨去除率的关系如图所示.pH较大时,氨去除率下降的原因是________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com