
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入Na2CO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
分析 A.水溶液中或熔融状态下自身电离出离子导电的化合物为电解质;
B.电离常数只与温度有关;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应;
D.HF属于弱电解质,加水不断稀释时,电离程度增大,但是电离平衡常数不变.
解答 解:A.水溶液中或熔融状态下自身电离出离子导电的化合物为电解质,二氧化硫溶于水和水反应生成亚硫酸是电解质导电,二氧化硫是非电解质,故A错误;
B.向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,但是电离常数只与温度有关,所以一水合氨的电离常数不变,故B错误;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应,则平衡向正方向移动,所以溶液中c(HClO)增大,故C正确;
D.因为因Ka(HF)=$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,温度不变,Ka(HF)不变,所以$\frac{c({H}^{+})}{c(HF)}$增大,故D错误.
故选C.
点评 本题考查了电解质的概念、平衡的移动、电离常数的影响因素和计算,题目综合性强,难度中等,D选项为易错项,注意判断离子浓度变化时,可以借助于平衡常数表达式,运用整体法判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(Na+)=c(OH-)>c(NH3•H2O) | B. | c(NH4+)=c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(Na+)>c(OH-)>c(NH3•H2O) | D. | c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2(g) | Cl2 (g) | HCl (g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 243 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液澄清透明,胶体浑浊不透明 | |
| B. | 加热和搅拌不可能引起胶体聚沉 | |
| C. | 将一束强光通过淀粉溶液时,能产生丁达尔现象 | |
| D. | 大气中PM2.5(直径≤2.5×10-6m的可吸入颗粒),一定属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℉、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应△H=+2×283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

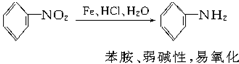


 ; B
; B ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Q | B. | 5Q~10Q | C. | 3Q | D. | 8Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人的人体内体液pH总保持恒定 | |
| C. | 食物的酸碱性与化学上所指溶液的酸碱性不同的 | |
| D. | 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com