解:(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,二者发生反应制备氯气,反应的化学方程式为4HCl+Ca(ClO)
2=CaCl
2+2Cl
2↑+2H
2O,先用饱和食盐水除去HCl,再经过浓硫酸干燥,然后与Al在B中反应生成氯化铝,氯气有毒,应有尾气处理装置,
故答案为:4HCl+Ca(ClO)
2=CaCl
2+2Cl
2↑+2H
2O;浓硫酸;除去尾气氯气,并防止空气中的水进入B装置;
(2)过氧化钠与水反应生成氧气,与氨气经盛有碱石灰的干燥管干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理,则连接顺序为A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液),NO和氧气反应生成红棕色的二氧化氮气体,在B中可观察到红棕色,
故答案为:A→D→B→D(D盛装碱石灰)或A→D→B→C(C盛装氢氧化钠溶液);B装置中有红棕色气体出现;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应:2Mg+CO
2
2MgO+C,为防止空气中氧气和氮气与镁反应,应先通入二氧化碳将空气排出,
故答案为:饱和NaHCO
3溶液;2Mg+CO
2
2MgO+C;打开分液漏斗的活塞,先通一段时间的二氧化碳;
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体,发生反应分别为2CaC
2+5O
2
2CaO+4CO
2;2CaS+3O
2
2CaO+2SO
2,可用品红和澄清石灰水检验,
若反应前B中样品质量为8.40g,反应后B中残留固体质量为7.28g,设CaC
2为xmol,CaS为ymol,则
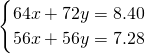
解得x=0.12mol,
则m(CaC
2)=0.17mol×64g/mol=7.68g,
ω(CaC
2)=
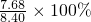
=91.4%,
故答案为:2CaC
2+5O
2
2CaO+4CO
2;2CaS+3O
2
2CaO+2SO
2;91.4%.
分析:(1)若锥形瓶中盛装漂白粉固体,分液漏斗中盛装浓盐酸,二者发生反应制备氯气,经除杂、干燥后与Al在B中反应生成氯化铝,氯气有毒,应有尾气处理装置;
(2)过氧化钠与水反应生成氧气,与氨气经干燥后在催化剂的作用下反应生成NO,剩余气体必须进行尾气处理;
(3)大理石和盐酸反应生成二氧化碳气体混有HCl,先经过饱和碳酸氢钠溶液除杂,干燥后和镁在加热条件下可发生反应;
(4)双氧水在二氧化锰催化剂条件下反应生成氧气,经干燥后与碳化钙样品反应生成二氧化硫和二氧化碳气体可用品红和澄清石灰水检验.
点评:本题考查较为综合,涉及物质的制备、除杂以及性质检验等知识,题目难度中等,注意把握实验方法和步骤.


 2MgO+C,为防止空气中氧气和氮气与镁反应,应先通入二氧化碳将空气排出,
2MgO+C,为防止空气中氧气和氮气与镁反应,应先通入二氧化碳将空气排出, 2MgO+C;打开分液漏斗的活塞,先通一段时间的二氧化碳;
2MgO+C;打开分液漏斗的活塞,先通一段时间的二氧化碳; 2CaO+4CO2;2CaS+3O2
2CaO+4CO2;2CaS+3O2 2CaO+2SO2,可用品红和澄清石灰水检验,
2CaO+2SO2,可用品红和澄清石灰水检验,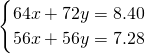
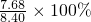 =91.4%,
=91.4%, 2CaO+4CO2;2CaS+3O2
2CaO+4CO2;2CaS+3O2 2CaO+2SO2;91.4%.
2CaO+2SO2;91.4%.

 阅读快车系列答案
阅读快车系列答案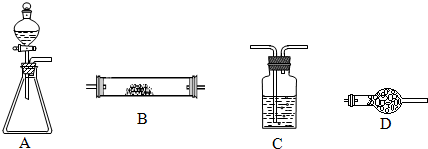
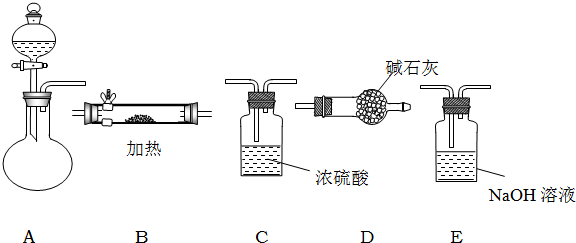
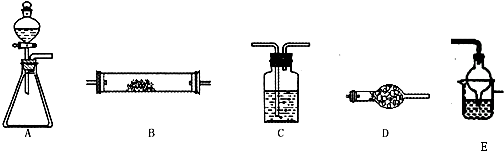
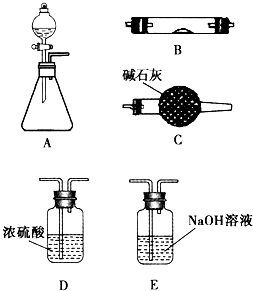 如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.
如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.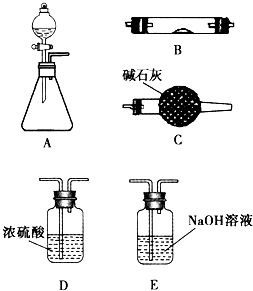 如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.
如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持装置均已略去).请根据下列要求回答问题.