
Éś²ś¼×“¼µÄŌĮĻCO”¢H2æÉÓÉĻĀĮŠ·“Ó¦ÖĘČ”£ŗCH4£Øg£©+H2O£Øg£©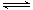 CO£Øg£©+3H2£Øg£©£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā”£
CO£Øg£©+3H2£Øg£©£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©ŅŃÖŖ£ŗ¢Ł CH4£Øg£©+3/2 O2£Øg£©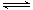 CO£Øg£©+2H2O£Øg£©”÷Hl£»
CO£Øg£©+2H2O£Øg£©”÷Hl£»
¢Ś H2£Øg£©+1/2 O2£Øg£©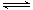 H2O£Øg£© ”÷H2£¬
H2O£Øg£© ”÷H2£¬
ŌņCH4£Øg£©+ H2O£Øg£©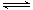 CO£Øg£©+3H2£Øg£©µÄ”÷H£½____ £ØÓĆŗ¬”÷H1£¬”÷H2µÄŹ½×Ó±ķŹ¾£©
CO£Øg£©+3H2£Øg£©µÄ”÷H£½____ £ØÓĆŗ¬”÷H1£¬”÷H2µÄŹ½×Ó±ķŹ¾£©
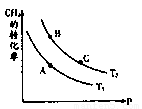
£Ø2£©Ņ»¶ØĢõ¼žĻĀ·“Ó¦CH4£Øg£©+H2O£Øg£© CO£Øg£©+3H2£Øg£©ÖŠCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼£¬ĒŅT2>T1£¬
ŌņÉĻŹö·“Ó¦µÄ”÷H____ 0£ØĢī”°<”±”¢”°>”±”¢”°=”±£¬ĻĀĶ¬£©£¬A”¢B“¦¶ŌÓ¦Ę½ŗā³£Źż£ØKA”¢KB£©µÄ“󊔹ŲĻµĪŖKA____
KB
CO£Øg£©+3H2£Øg£©ÖŠCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼£¬ĒŅT2>T1£¬
ŌņÉĻŹö·“Ó¦µÄ”÷H____ 0£ØĢī”°<”±”¢”°>”±”¢”°=”±£¬ĻĀĶ¬£©£¬A”¢B“¦¶ŌÓ¦Ę½ŗā³£Źż£ØKA”¢KB£©µÄ“󊔹ŲĻµĪŖKA____
KB
£Ø3£©Ī¬³ÖĪĀ¶ČT2£¬½«0.04 mol CH4ŗĶ0.04mol H2O£Øg£©ĶØČėČŻ»żĪŖ1LµÄ¶ØČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬Ę½ŗāŹ±“ļµ½Bµć£¬²āµĆCH4µÄ×Ŗ»ÆĀŹĪŖ50%,øĆ·“Ó¦ŌŚ“ĖĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżKB=____ £¬ĻĀĮŠĻÖĻóÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ_ ___
a£®ČŻĘ÷ÄŚCH4”¢H2O”¢CO”¢H2µÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ1£ŗ1£ŗ3
b£®ČŻĘ÷µÄĆܶČŗć¶Ø
c£®ČŻĘ÷µÄŃ¹Ēæŗć¶Ø
d£®3¦ŌÕż£ØCO£©£½¦ŌÄę£Ø£ØH2£©
£Ø4£©ŌŚÉĻŹöBµćĘ½ŗā»ł“”ÉĻ£¬ĻņČŻĘ÷ÖŠŌŁĶØČėamol CH4ŗĶa mol H2OĘųĢ壬Ź¹Ö®ŌŚCµćÖŲŠĀ“ļĘ½ŗā£¬“ĖŹ±²āµĆCOÓŠ0.03mol£¬Ōņa=____ ”£
£Ø1£©¦¤H1”Ŗ3¦¤H2 £Ø2·Ö£© £Ø2£©> £Ø2·Ö£©£» < £Ø2·Ö£©
£Ø3£©1.08”Į10£2mol2٠L£2 £Ø2·Ö£¬µ„Ī»æɲ»×÷ŅŖĒ󣩣»acd£Ø3·Ö£© £Ø4£©0.035£Ø3·Ö£©
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©øł¾ŻŅŃÖŖµÄČČ»Æѧ·½³ĢŹ½ŅŌ¼°øĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ł£¢Ś”Į3¼“µĆµ½CH4£Øg£©+ H2O£Øg£© CO£Øg£©+3H2£Øg£©£¬ĖłŅŌøĆ·“Ó¦µÄ·“Ó¦ČČ”÷H£½¦¤H1”Ŗ3¦¤H2”£
CO£Øg£©+3H2£Øg£©£¬ĖłŅŌøĆ·“Ó¦µÄ·“Ó¦ČČ”÷H£½¦¤H1”Ŗ3¦¤H2”£
£Ø2£©øł¾ŻĶ¼ĻńæÉÖŖ£¬ŌŚŃ¹ĒæĻąĶ¬Ź±£¬ĪĀ¶ČŌ½øߣ¬¼×ĶéµÄ×Ŗ»ÆĀŹŌ½øß”£ÕāĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬Ņņ“ĖÕż·“Ó¦ŹĒĪüČČ·“Ó¦£¬¼“”÷H£¾0”£ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬Ņņ“ĖBµć¶ŌÓ¦µÄĘ½ŗā³£Źż“óÓŚAµć¶ŌÓ¦µÄĘ½ŗā³£Źż”£
£Ø3£©
CH4£Øg£©+H2O£Øg£© CO£Øg£©+3H2£Øg£©
CO£Øg£©+3H2£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£© 0.04 0.04 0 0
×Ŗ»ÆÅØ¶Č£Ømol/L£© 0.02 0.02 0.02 0.06
Ę½ŗāÅØ¶Č£Ømol/L£© 0.02 0.02 0.02 0.06
ĖłŅŌøĆĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżKB£½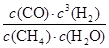 £½
£½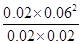 £½1.08”Į10”Ŗ2mol2٠L£2
£½1.08”Į10”Ŗ2mol2٠L£2
ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±æÉÄę·“Ó¦ÖŠÕż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹĻąµČŹ±£Øµ«²»ĪŖ0£©£¬ø÷ÖÖĪļÖŹµÄÅØ¶Č»ņŗ¬Įæ¾ł²»ŌŁ·¢Éś±ä»ÆµÄדĢ¬£¬ŹĒ»ÆŃ§Ę½ŗāדĢ¬£¬øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬Ę½ŗāŹ±ČŻĘ÷ÄŚCH4”¢H2O”¢CO”¢H2µÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1:1:3£¬ĖłŅŌæÉŅŌĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬aÕżČ·£»ĆܶȏĒ»ģŗĻĘųµÄÖŹĮæŗĶČŻĘ÷ČŻ»żµÄ±ČÖµ£¬ŌŚ·“Ó¦¹ż³ĢÖŠÖŹĮæŗĶČŻ»żŹ¼ÖÕŹĒ²»±äµÄ£¬Ņņ“ĖĆܶȏ¼ÖÕŹĒ²»±äµÄ£¬ĖłŅŌb²»ÄÜĖµĆ÷£»øĆ·“Ó¦ŹĒĢå»ż¼õŠ”µÄæÉÄę·“Ó¦£¬ĖłŅŌµ±Ń¹Ēæ²»ŌŁ·¢Éś±ä»ÆŹ±£¬æÉŅŌĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¼“cÕżČ·£»dÖŠµÄ·“Ó¦ĖŁĀŹ·½ĻņĻą·“£¬ĒŅĀś×ć·“Ó¦ĖŁĀŹÖ®±ČŹĒĻąÓ¦µÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬Ņņ“ĖæÉŅŌĖµĆ÷£¬dÕżČ·£¬“š°øŃ”acd”£
£Ø4£©
CH4£Øg£©+H2O£Øg£© CO£Øg£©+3H2£Øg£©
CO£Øg£©+3H2£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£© b b 0 0
×Ŗ»ÆÅØ¶Č£Ømol/L£© 0.03 0.03 0.03 0.09
Ę½ŗāÅØ¶Č£Ømol/L£©b£0.03 b£0.03 0.03 0.09
ŅņĪŖĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬ĖłŅŌ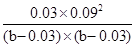 £½1.08”Į10”Ŗ2£¬½āµĆb£½0.075mol£¬Ņņ“Ėa£½0.075mol£0.04mol£½0.035mol
£½1.08”Į10”Ŗ2£¬½āµĆb£½0.075mol£¬Ņņ“Ėa£½0.075mol£0.04mol£½0.035mol
æ¼µć£ŗæ¼²éøĒĖ¹¶ØĀɵÄÓ¦ÓĆ£»Ķā½ēĢõ¼ž¶ŌĘ½ŗāדĢ¬µÄÓ°Ļģ£»Ę½ŗā³£ŹżµÄ¼ĘĖćŗĶÓ¦ÓƵČ


 ĘŚÄ©³å“Ģ100·Ö““ŠĀ½š¾ķĶźČ«ŹŌ¾ķĻµĮŠ“š°ø
ĘŚÄ©³å“Ģ100·Ö““ŠĀ½š¾ķĶźČ«ŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ¹ć¶«Ź”¹ćÖŻĮłÖŠø߶žÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌĄķæĘ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
¼×“¼ŹĒŅ»ÖÖÓÅÖŹČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©¹¤ŅµÉĻæÉÓĆĻĀĮŠĮ½ÖÖ·“Ó¦Öʱø¼×“¼£ŗ
CO(g) + 2H2(g)  CH3OH(g) ¦¤H1
CH3OH(g) ¦¤H1
CO2(g) £« 3H2(g)  CH3OH(g) + H2O(g) ¦¤H2
CH3OH(g) + H2O(g) ¦¤H2
ŅŃÖŖ£ŗ2H2(g)+ O2(g) £½ 2H2O(g) ¦¤H3”£Ōņ2CO(g)£«O2(g) £½ 2CO2(g) µÄ·“Ó¦ČČ
¦¤H£½_____________£ØÓƦ¤H1”¢¦¤H2”¢¦¤H3±ķŹ¾£©”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚ£ŗCH4(g) + H2O(g)  CO(g) + 3H2(g) ¦¤H4”£
CO(g) + 3H2(g) ¦¤H4”£
Ņ»¶ØĢõ¼žĻĀCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£Ōņ¦¤H4______0£¬P1_________P2
£ØĢī”°<”±”¢”°>”±»ņ”°£½”±£©
£Ø3£©Ä³ŹµŃ銔×éÉč¼ĘČēĶ¼bĖłŹ¾µÄ¼×“¼Č¼ĮĻµē³Ų×°ÖĆ£¬¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬ČÜŅŗµÄPH (ĢīŌö“󔢼õŠ””¢²»±ä)”£øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ_______ ______”£
£Ø4£©»ĘĶæóČŪĮ¶ŗóµĆµ½µÄ“ÖĶŗ¬ÉŁĮæFe”¢Ag”¢AuµČ½šŹōŌÓÖŹ£¬Šč½ųŅ»²½²ÉÓƵē½ā·Ø¾«ÖĘ”£“ÖĶµē½āµĆµ½¾«ĶµÄµÄµē½ā³ŲÖŠ£¬Ńō¼«²ÄĮĻŹĒ £»Ņõ¼«²ÄĮĻŹĒ £»
Ńō¼«ÄąĪŖ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ½Ī÷Ź”¼Ŗ°²ŹŠøßČżÉĻѧʌʌĩ½Ģѧ֏ĮæĘĄ¼Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
æŖ·¢Ź¹ÓĆĒå½ąÄÜŌ“£¬·¢Õ¹”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā”£ĒāĘų”¢¼×“¼ŹĒÓÅÖŹµÄĒå½ąČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©¼×ĶéĖ®ÕōĘų×Ŗ»Æ·ØÖĘH2µÄÖ÷ŅŖ×Ŗ»Æ·“Ó¦ČēĻĀ£ŗ
CH4(g) + H2O(g) CO(g) + 3H2(g)? ”÷H=+206£®2 kJ”¤mol£1
CO(g) + 3H2(g)? ”÷H=+206£®2 kJ”¤mol£1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? ”÷H=+165£®0 kJ”¤mol£1
CO2(g) + 4H2(g)? ”÷H=+165£®0 kJ”¤mol£1
ÉĻŹö·“Ó¦ĖłµĆŌĮĻĘųÖŠµÄCOÄÜŹ¹ŗĻ³É°±µÄ“߻ƼĮÖŠ¶¾£¬±ŲŠė³żČ„”£¹¤ŅµÉĻ³£²ÉÓĆ“ß»Æ¼Į“ęŌŚĻĀCOÓėĖ®ÕōĘų·“Ӧɜ³ÉŅ׳żČ„µÄCO2£¬Ķ¬Ź±æÉÖʵƵČĢå»żµÄĒāĘųµÄ·½·Ø”£“Ė·“Ó¦³ĘĪŖŅ»Ńõ»ÆĢ¼±ä»»·“Ó¦£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ??????? ”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚ£ŗCH4(g) + H2O(g)  CO(g) + 3H2(g)? ¦¤H>0
CO(g) + 3H2(g)? ¦¤H>0
¢ŁŅ»¶ØĢõ¼žĻĀCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£ŌņA”¢B”¢CČżµć“¦¶ŌÓ¦Ę½ŗā³£Źż£ØKA”¢KB”¢KC£©µÄ“󊔹ŲĻµĪŖ___________”£(Ģī”°<”±”¢”°>”±”¢”°=”± )£»

¢Ś100”ꏱ£¬½«1 mol CH4ŗĶ2 mol H2OĶØČėČŻ»żĪŖ1 LµÄ¶ØČŻĆÜ·āČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ__________
a£®ČŻĘ÷ÄŚĘųĢåĆܶČŗć¶Ø??
b£®µ„Ī»Ź±¼äÄŚĻūŗÄ0£®1 mol CH4Ķ¬Ź±Éś³É0£®3 mol H2
c£®ČŻĘ÷µÄŃ¹Ēæŗć¶Ø??????
d£®3vÕż(CH4) = vÄę(H2)
£Ø3£©25”ꏱ£¬ŌŚ20mL0£®1mol/LĒā·śĖįÖŠ¼ÓČėVmL0£®1mol/LNaOHČÜŅŗ£¬²āµĆ»ģŗĻČÜŅŗµÄpH±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_____”£

A£®pH£½3µÄHFČÜŅŗŗĶpH£½11µÄNaFČÜŅŗÖŠ£¬ ÓÉĖ®µēĄė³öµÄc(H+)ĻąµČ
B£®¢ŁµćŹ±pH£½6£¬“ĖŹ±ČÜŅŗÖŠ£¬c(F£)£c(Na+)£½9£®9”Į10-7mol/L
C£®¢ŚµćŹ±£¬ČÜŅŗÖŠµÄc(F£)£½c(Na+)
D£®¢ŪµćŹ±V£½20mL£¬“ĖŹ±ČÜŅŗÖŠc(Na+)£½0£®1mol/L
£Ø4£©³¤ĘŚŅŌĄ“£¬Ņ»Ö±ČĻĪŖ·śµÄŗ¬ŃõĖį²»“ęŌŚ”£1971ğƥ¹śæĘѧ¼ŅÓĆ·śĘųĶعżĻø±łÄ©Ź±»ńµĆHFO£¬Ęä½į¹¹Ź½ĪŖH”ŖO”ŖF”£HFOÓėĖ®·“Ó¦µĆµ½HFŗĶ»ÆŗĻĪļA£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ????????????????????? ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014Ń§ÄźÉ½¶«Ź”Ģ©°²ŹŠøßČżµŚŅ»ĀÖø“Ļ°ÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĒāĘų”¢¼×“¼ŹĒÓÅÖŹµÄĒå½ąČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©ŅŃÖŖ£ŗ¢Ł =
= mol
mol
¢Ś =
= mol
mol ?
?
¢Ū =
= mol
mol
Š“³ö¼×“¼²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ŗĶŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½?????????????????????? ”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚĻĀĮŠ·“Ó¦£ŗ

¢ŁŅ»¶ØĢõ¼žĻĀ µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£Ōņ
µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£Ōņ ??????????
??????????  (Ģī”°<”±”¢”°>”±»ņ”°="£¬ĻĀĶ¬)£»A”¢B”¢CČżµć“¦¶ŌÓ¦Ę½ŗā³£Źż(
(Ģī”°<”±”¢”°>”±»ņ”°="£¬ĻĀĶ¬)£»A”¢B”¢CČżµć“¦¶ŌÓ¦Ę½ŗā³£Źż( )µÄ“󊔹ŲĻµĪŖ?????????? £»
)µÄ“󊔹ŲĻµĪŖ?????????? £»

¢Ś100”ꏱ£¬½«1 mol  ŗĶ2 mol
ŗĶ2 mol  ĶØČėČŻ»żĪŖ1LµÄ¶ØČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ???????????? (ĢīŠņŗÅ)”£
ĶØČėČŻ»żĪŖ1LµÄ¶ØČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ???????????? (ĢīŠņŗÅ)”£
a£®ČŻĘ÷µÄŃ¹Ēæŗć¶Ø
b£®µ„Ī»Ź±¼äÄŚĻūŗÄ0.1 mol CH4Ķ¬Ź±Éś³É0.3 molH2
c£®ČŻĘ÷ÄŚĘųĢåĆܶČŗć¶Ø
d£®
Čē¹ū“ļµ½Ę½ŗāŹ± µÄ×Ŗ»ÆĀŹĪŖ0£®5£¬Ōņ100”ꏱøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=??????????? ”£
µÄ×Ŗ»ÆĀŹĪŖ0£®5£¬Ōņ100”ꏱøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=??????????? ”£
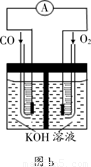
£Ø3£©Ä³ŹµŃ銔×éĄūÓĆCO(g)”¢ ”¢KOH(aq)Éč¼Ę³ÉČēĶ¼bĖłŹ¾µÄµē³Ų×°ÖĆ£¬ŌņøƵē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ???????????? ”£
”¢KOH(aq)Éč¼Ę³ÉČēĶ¼bĖłŹ¾µÄµē³Ų×°ÖĆ£¬ŌņøƵē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ???????????? ”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ±±¾©ŹŠĶØÖŻĒųøßȿğ¼¶ÉĻѧʌʌĩƞµ×æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
æŖ·¢”¢Ź¹ÓĆĒå½ąÄÜŌ“·¢Õ¹”°µĶĢ¼¾¼Ć”±£¬Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā”£ĒāĘų”¢¼×“¼ŹĒÓÅÖŹµÄĒå½ąČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©ŅŃÖŖ£ŗ¢Ł 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ¦¤H1 = ØC 1275.6 kJ/mol
¢Ś 2CO(g) + O2(g) = 2CO2(g) ¦¤H2 = ØC 566.0 kJ/mol
¢Ū H2O(g) = H2O(1) ¦¤H3 = ØC 44.0 kJ/mol
Š“³ö¼×“¼²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ŗĶŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½£ŗ___________”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚ£ŗCH4(g) + H2O(g)  CO(g)
+ 3H2(g) ¦¤H>0
CO(g)
+ 3H2(g) ¦¤H>0
¢ŁŅ»¶ØĢõ¼žĻĀCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£ŌņTl ________T2(Ģī”°<”±”¢”°>”±”¢”°=”±£¬ĻĀĶ¬)£»A”¢B”¢CČżµć“¦¶ŌÓ¦Ę½ŗā³£Źż£ØKA”¢KB”¢KC£©µÄ“󊔹ŲĻµĪŖ___________”£

¢Ś100”ꏱ£¬½«1 mol CH4ŗĶ2 mol H2OĶØČėČŻ»żĪŖ1 LµÄ¶ØČŻĆÜ·āČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ__________
a£®ČŻĘ÷ÄŚĘųĢåĆܶČŗć¶Ø
b£®µ„Ī»Ź±¼äÄŚĻūŗÄ0.1 mol CH4Ķ¬Ź±Éś³É0.3 mol H2
c£®ČŻĘ÷µÄŃ¹Ēæŗć¶Ø
d£®3vÕż(CH4) = vÄę(H2)
Čē¹ū“ļµ½Ę½ŗāŹ±CH4µÄ×Ŗ»ÆĀŹĪŖ0.5£¬Ōņ100”ꏱøĆ·“Ó¦µÄĘ½ŗā³£ŹżK =___________
£Ø3£©Ä³ŹµŃ銔×éĄūÓĆCO(g) ”¢ O2(g) ”¢KOH£Øaq£©Éč¼Ę³ÉČēĶ¼bĖłŹ¾µÄµē³Ų×°ÖĆ£¬ŌņøƵē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014½ģ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌĄķæĘ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
¼×“¼ŹĒŅ»ÖÖÓÅÖŹČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©¹¤ŅµÉĻæÉÓĆĻĀĮŠĮ½ÖÖ·“Ó¦Öʱø¼×“¼£ŗ
CO(g) + 2H2(g)  CH3OH(g) ¦¤H1
CH3OH(g) ¦¤H1
CO2(g) £« 3H2(g)
 CH3OH(g) + H2O(g) ¦¤H2
CH3OH(g) + H2O(g) ¦¤H2
ŅŃÖŖ£ŗ2H2(g)+ O2(g) £½ 2H2O(g) ¦¤H3”£Ōņ2CO(g)£«O2(g) £½ 2CO2(g) µÄ·“Ó¦ČČ
¦¤H£½_____________£ØÓƦ¤H1”¢¦¤H2”¢¦¤H3±ķŹ¾£©”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚ£ŗCH4(g) + H2O(g)  CO(g) + 3H2(g) ¦¤H4”£
CO(g) + 3H2(g) ¦¤H4”£
Ņ»¶ØĢõ¼žĻĀCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£Ōņ¦¤H4______0£¬P1_________P2
£ØĢī”°<”±”¢”°>”±»ņ”°£½”±£©
£Ø3£©Ä³ŹµŃ銔×éÉč¼ĘČēĶ¼bĖłŹ¾µÄ¼×“¼Č¼ĮĻµē³Ų×°ÖĆ£¬¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬ČÜŅŗµÄPH (ĢīŌö“󔢼õŠ””¢²»±ä)”£øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ_______ ______”£

£Ø4£©»ĘĶæóČŪĮ¶ŗóµĆµ½µÄ“ÖĶŗ¬ÉŁĮæFe”¢Ag”¢AuµČ½šŹōŌÓÖŹ£¬Šč½ųŅ»²½²ÉÓƵē½ā·Ø¾«ÖĘ”£“ÖĶµē½āµĆµ½¾«ĶµÄµÄµē½ā³ŲÖŠ£¬Ńō¼«²ÄĮĻŹĒ £»Ņõ¼«²ÄĮĻŹĒ £»
Ńō¼«ÄąĪŖ£ŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com