
分析 已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③.
结合目标反应,利用盖斯定律将所给的反应做相应的变形,反应热做相应的变化即可,据此分析.
解答 解:已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③.
将③+②×2-①×2可得:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H4=△H3+2△H2-2△H1=-1527.6KJ/mol,
故答案为:-1527.6KJ/mol.
点评 本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写,题目难度不大,注意把握盖斯定律的含义和热化学方程式的书写要求.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 分解反应都是吸热反应,化合反应都是放热反应 | |
| C. | 若反应放热,则反应物的总能量大于生成物的总能量 | |
| D. | 利用化学反应可以合成自然界中不存在的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态铜原子的价电子排布图: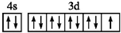 | |
| B. | CO2分子立体结构模型: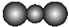 | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W的原子序数可能是Y的两倍 | |
| B. | Z的原子半径比X的大 | |
| C. | Y元素的非金属性比Z元素的强 | |
| D. | Z的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
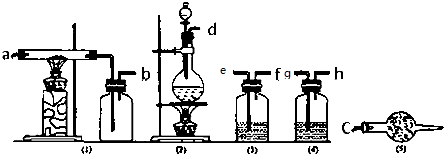
| 仪器标号 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 试剂标号 | G | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com