
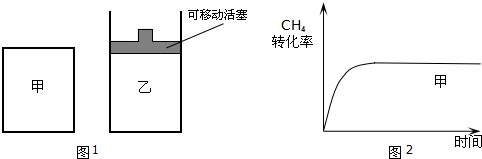
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
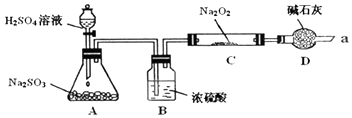
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
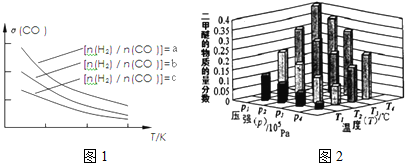
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
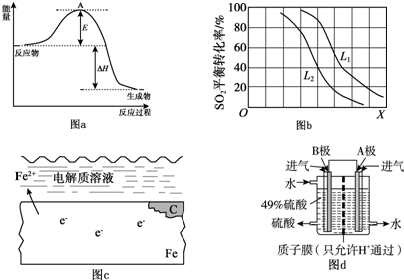
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
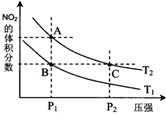 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com