
氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是 ( )
A.“两水”都是混合物,溶液中含有的粒子种类、数目相同
B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡
C.“两水”都有刺激性气味,都能漂白有机色素
D.“两水”放置时间较久后,都会因为相同的原理而变质
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574 kJ·mol-1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48 L CH4还原NO2至N2则放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
①汽车尾气中的CO来自于____________________,NO来自于_____________________。汽车尾气对环境的危害主要有________________________(至少填两种)。
②汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应的化学方程式可表示为__________________________。
(2)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO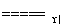 5N2+6H2O,8NH3+6NO2
5N2+6H2O,8NH3+6NO2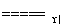 7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的铁和足量的稀硝酸或浓硝酸完全反应,在相同条件下,用排水集气法收集产生的气体。下列叙述一定正确的是 ( )
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Fe(NO3)3的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同
A.只有② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO +H2O
+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
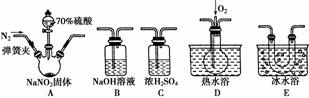
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是_______________________________
________________________________________________________________________。
②装置E的作用是_______________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________
________________________________________________________
________________。如果没有装置C,对实验结论造成的影响是__________________
______________________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN-===Fe(SCN)3,具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL 1 mol/L FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成血红色。
②取少量血红色溶液,滴加少许浓硝酸,静置,溶液变为无色,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中无色溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为________________;E的化学式为__________。
(2)混合气体A的成分是________________(填化学式)。
(3)兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,反应②中被氧化的元素是________________(填元素符号)。
(4)实验②中,还原剂与氧化剂的物质的量之比为_________。
(5)小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,x g甲气体和y g乙气体占有相同的体积,根据阿伏加德罗定律判断下列叙述错误的是 ( )
A.x∶y等于甲与乙的相对分子质量之比
B.x∶y等于甲与乙的分子个数之比
C.x∶y等于同温同压下甲与乙的密度之比
D.y∶x等于同温同体积下,等质量的甲与乙的压强之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com