
| A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B.用焰色反应鉴别NaCl和KCl |
| C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体 |
| D.用BaCl2溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
科目:高中化学 来源:不详 题型:填空题
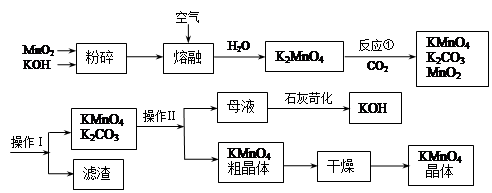
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KSCN | B.NaOH | C.HCl | D.BaCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
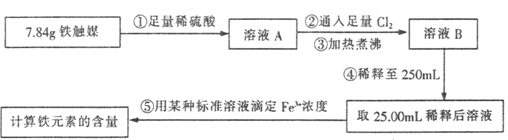
| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 | 若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |
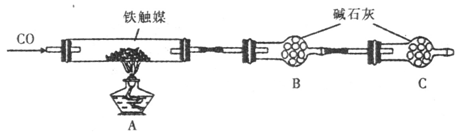
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用灼烧并闻气味的方法检验真皮衣料 |
| B.用淀粉和水检验食盐中的碘元素 |
| C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
| D.用食醋除去热水壶中的水垢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑥⑦①⑤ | B.⑥⑧ | C.④②③①⑤ | D.②①⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
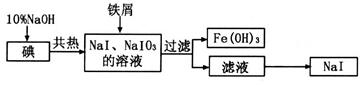
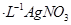 溶液滴定至终点,消耗
溶液滴定至终点,消耗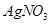 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水溶性 |
| 甲 | C3H6O2 | -98 | 55.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CH3CH2Br+H2O
CH3CH2Br+H2O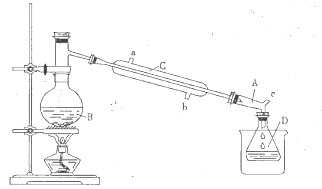
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com