
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |


科目:高中化学 来源: 题型:
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、液溴的保存用带橡胶塞的棕色试剂瓶 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3滴加稀盐酸:OH-+H+=H2O |
| B、Fe片浸泡在FeCl3溶液中:Fe3++Fe=2Fe2+ |
| C、NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓ |
| D、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中加入盐酸 CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钡溶液中加入硫酸 H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述混合液B分置于试管1、试管2中. | |
| 步骤2 | 往试管1中滴加 | |
| 步骤3 | 往试管2中滴加 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| … | E | A | B | ||
| C | … | D |
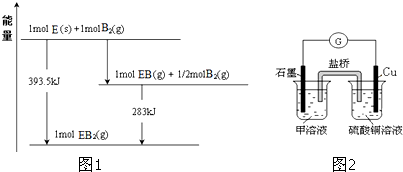
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com