
| A. | 标准状况下1molSO3的体积为22.4L | B. | 标准状况下CO2的密度比SO2大 | ||
| C. | 1molSO42-的质量为94g | D. | 1molOH-含有10mol电子 |
分析 A、标准状况下三氧化硫不是气体;
B、标准状况气体密度之比等于气体摩尔质量之比;
C、依据n=$\frac{m}{M}$,计算得到硫酸根离子的质量;
D、氢氧根离子含有10个电子分析.
解答 解:A、标准状况下三氧化硫不是气体,标准状况下1molSO3的体积不是22.4L,故A错误;
B、标准状况气体密度之比等于气体摩尔质量之比,SO2密度大于CO2,故B错误;
C、依据n=$\frac{m}{M}$,计算得到硫酸根离子的质量=1mol×96g/mol=96g,故C错误;
D、氢氧根离子含有10个电子,1molOH-含有10mol电子,故D正确;
故选D.
点评 本题考查了气体摩尔体积的概念实质和条件应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{氯气}$ SiCl4 $→_{高温}^{氢气}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$ MgCl2(aq)$\stackrel{电解}{→}$ Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$ FeCl3(aq)$\stackrel{蒸发}{→}$ 无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{加热}^{蔗糖}$ Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{3}$mol | B. | $\frac{4}{3}$mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
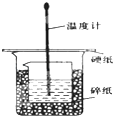 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,碳为负极 | |
| B. | 负极反应为2NH4++2e-═2NH3↑+H2↑ | |
| C. | 工作时电子由碳极经外电路流向锌极 | |
| D. | 长时间连续使用时,内装的糊状物可能流出腐蚀电器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com