
| A. | 0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:c(CH3COOH)+c(CH3COO-)=0.2mol/L |
分析 A.碳酸氢钠溶液中碳酸氢根离子水解溶液显碱性;
B.向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液反应生成硫酸铵和硫酸钠,溶液中铵根离子水解溶液显酸性;
C.碳酸钠溶液中存在电荷守恒分析判断;
D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合,溶液中存在物料守恒;
解答 解:A.0.1mol/LNaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故A错误;
B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液反应生成硫酸铵和硫酸钠,溶液中铵根离子水解溶液显酸性:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合,溶液中存在物料守恒c(CH3COOH)+c(CH3COO-)=2c(Na+)=0.1mol/L,故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小、电解质溶液中电荷守恒、物料守恒、盐类水解等知识点,掌握基础是解题关键,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:实验题
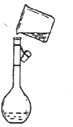 实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.
实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{32m}{n}$ | B. | $\frac{16m}{n}$ | C. | $\frac{32n}{m}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量 | |
| C. | 棉花、蚕丝和锦纶的主要成分都是纤维素 | |
| D. | 为了防止中秋月饼等富含脂食品氧化变质,延长保质期,可以包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com