
| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
分析 A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同,则A、B位于周期表同一主族,且B在A的下一周期,结合元素周期律的递变规律解答该题.
解答 解:A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同,则A、B位于周期表同一主族,且B在A的下一周期,则:
A.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,若HnAOm是强酸,则B的最高价氧化物对应的水化物不一定为强酸,故A错误;
B.同主族元素从上到下元素的金属性逐渐增强,若B为非金属元素,则A一定为非金属元素,故B错误;
C.常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体,如O、S,故C正确;
D.主族元素从上到下元素的金属性逐渐增强,则碱性:B(OH)m大于A(OH)m,若B(OH)m是强碱,A(OH)m可能为弱碱,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
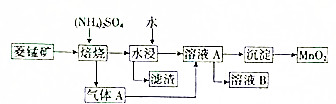 锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

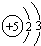 ;
;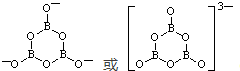 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
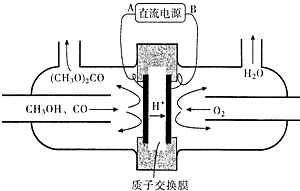
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com