
【题目】下列说法不正确的是
①盐酸与足量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
③对反应3H2(g)+N2(g)![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
④对于反应3KSCN(aq)+ FeCl3(aq)![]() Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①②④ B. ②③ C. ②③④ D. ①③④
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
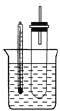
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
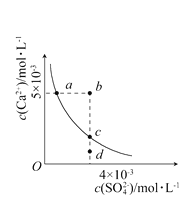
A. 在任何溶液中,c(Ca2+)、c(SO42-)均相等
B. b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol·L-1
C. a点对应的Ksp等于c点对应的Ksp
D. d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是

A. 该反应为吸热反应
B. 升高温度,不改变活化分子百分数
C. 使用催化剂会使该反应的反应热发生改变
D. △H =-(E2-E1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应为Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法不正确的是(已知阴离子交换膜的作用是只允许阴离子通过)( )

A.通入氧气的电极为正极
B.放电时,溶液中的OH-移向负极
C.负极的电极反应式为Mg-2e-+2OH-=Mg(OH)2
D.当电路中转移0.04mol电子时,参加反应的O2为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4(g)![]() 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是

A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y
D. 使E状态从水平方向到达C状态,从理论上来讲可选用的条件是从P1突然加压至P2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是

A. Ag2C2O4+2Cl-![]() 2AgCl+C2O42-的平衡常数为109.04
2AgCl+C2O42-的平衡常数为109.04
B. N点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ksp(Ag2C2O4)的数量级等于10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A. 最高正化合价:Z>X
B. X、Y、Z的单质中,Z的熔点最高
C. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
D. 若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com