
ЁОЬтФПЁПСђѕЃТШ(SO2C12)КЭТШЛЏбЧэП(SOC12)дкПеЦјжагіЫЎеєЦјЗЂЩњОчСвЗДгІЃЌВЂВњЩњДѓСПАзЮэЁЃСђѕЃТШ(SO2C12)ГЃгУзїТШЛЏМСЛђТШЛЧЛЏМСЃЌгУгкжЦзївЉЦЗЁЂШОСЯЁЂБэУцЛюадМСЕШЁЃКЯГЩЕФЗДгІЪНЮЊ: SO2(g) + Cl2(g)![]() SO2Cl2(l) ЁїH=-197.3 kJЁЄmol-1
SO2Cl2(l) ЁїH=-197.3 kJЁЄmol-1
ЮяжЪ | ШлЕу/Ёц | ЗаЕу/Ёц | ЦфЫћаджЪ |
SO2C12 | -54.1 | 69.1 | взЗжНтЃКSO2C12 |
КЯГЩSO2C12ЕФзАжУШчЯТЭМЫљЪО(МаГжвЧЦївбЪЁТдЃЉЃЌЧыЛиД№гаЙиЮЪЬт:
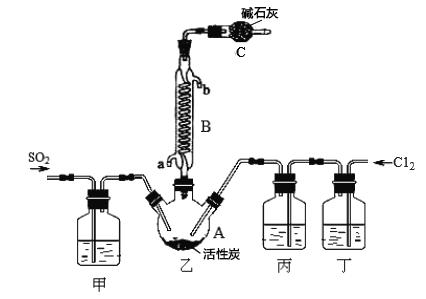
(1)ДгЯТБэжабЁдёЯргІЕФзАжУЭъГЩЬюПе:
ЂйжЦБИSO2бЁ________(ЬюзжФИ)ЁЃ
ЂкаДГігУЫљбЁзАжУжЦШЁCl2ЕФРызгЗНГЬЪН_________________ЁЃ
(2)КЯГЩSO2C12ЕФзАжУЭМжавЧЦїBЕФУћГЦЮЊ_________________ЃЛЖЁжаЪЂЗХЕФЪЧ_____________ЁЃ
(3)ЗДгІНсЪјКѓЃЌНЋввжаЛьКЯЮяЗжРыПЊЕФЪЕбщВйзїУћГЦЪЧ _______________ЁЃ
(4)ЭМжазАжУCЕФзїгУЪЧ__________________ЁЃ
(5)ЮЊЬсИпБОЪЕбщжаЕФВњТЪ,дкЪЕбщВйзїжаЛЙашвЊзЂвтЕФЪТЯюга(жЛД№ЁЊЬѕМДПЩ)__________ЁЃ
(6)ТШЛЏбЧэП(SOCl2)гыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____ЃЌеєИЩA1C13ШмвКВЛФмЕУЕНЮоЫЎAlCl3ЃЌгУSOC12гыAlCl3 6H2OЕФЛьКЯМгШШЃЌПЩЕУЕНЮоЫЎA1C13ЃЌЪдНтЪЭдвђ__________ЁЃ
ЁОД№АИЁП D ClO3-+5Cl-+6H+=3Cl2Ёќ+3H2O ЧђаЮРфФ§Йм БЅКЭЪГбЮЫЎ еєСѓ ЮќЪеЮДЗДгІЕФТШЦјКЭЖўбѕЛЏСђЃЌЗРжЙПеЦјжаЕФЫЎеєЦјНјШыШ§ОБЦП ПижЦЦјСїЫйТЪЃЌвЫТ§ВЛвЫПьЃЛШєШ§ОБЦПФкЮТЖШНЯИпЃЌПЩЪЪЕБНЕЮТЃЛЯШЭЈРфЫЎЃЌдйНјааЪЕбщ SOCl2+H2O=SO2Ёќ+2HClЁќ SOCl2гыAlCl3ЁЄ6H2OжаЕФНсОЇЫЎзїгУЃЌЩњГЩЮоЫЎAlCl3МАSO2КЭHClЦјЬхЃЌВњЮяSO2КЭHClвжжЦAlCl3ЫЎНт
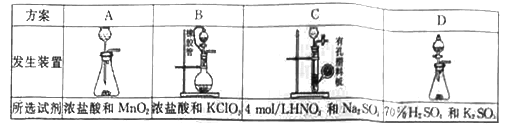
ЁОНтЮіЁП(1)ЂйAжаХЈбЮЫсгыЖўбѕЛЏУЬГЃЮТЯТВЛЗДгІЩњГЩТШЦјЃЌДэЮѓЃЛBжаХЈбЮЫсгыТШЫсМиЗДгІЩњГЩТШЦјЃЌДэЮѓЃЛCжаЯѕЫсФмЙЛНЋЩњГЩЕФЖўбѕЛЏСђбѕЛЏГЩСђЫсЃЌДэЮѓЃЛDжа70%ЕФСђЫсгыбЧСђЫсМиЗДгІЩњГЩЖўбѕЛЏСђЃЌе§ШЗЃЛЙЪбЁDЃЛ
ЂкAжаХЈбЮЫсгыЖўбѕЛЏУЬГЃЮТЯТВЛЗДгІЃЌгІИУбЁгУBЃЌЗДгІЕФРызгЗНГЬЪНЮЊClO3-+5Cl-+6H+=3Cl2Ёќ+3H2OЃЌЙЪД№АИЮЊЃКClO3-+5Cl-+6H+=3Cl2Ёќ+3H2OЃЛ
(2)КЯГЩSO2C12ЕФзАжУЭМжавЧЦїBЮЊЧђаЮРфФ§ЙмЃЛХЈбЮЫсОпгаЛгЗЂадЃЌЩњГЩЕФТШЦјжаЛьгаТШЛЏЧтЃЌЖЁжаЪЂЗХБЅКЭЪГбЮЫЎЃЌПЩвдЮќЪеЦфжаЕФТШЛЏЧтЃЌЙЪД№АИЮЊЃКЧђаЮРфФ§ЙмЃЛБЅКЭЪГбЮЫЎЃЛ
(3)ИљОнЬтвтЃЌСђѕЃТШ(SO2C12)ЕФЗаЕуНЯЕЭЃЌШнвзЛгЗЂЃЌЗДгІНсЪјКѓЃЌПЩвдЭЈЙ§еєСѓЕФЗНЗЈНЋЛьКЯЮяЗжРыПЊЃЌЙЪД№АИЮЊЃКеєСѓЃЛ
(4)ЃЌжЦБИЙ§ГЬжаЩцМАЕНЖўбѕЛЏСђКЭТШЦјЕШЮлШОПеЦјЕФЮяжЪЃЌВЂЧвСђѕЃТШ(SO2C12)дкПеЦјжагіЫЎеєЦјЗЂЩњОчСвЕФЫЎНтЗДгІЃЌвђДЫЭМжазАжУCПЩвдЮќЪеЮДЗДгІЕФТШЦјКЭЖўбѕЛЏСђЃЌЭЌЪБПЩвдЗРжЙПеЦјжаЕФЫЎеєЦјНјШыШ§ОБЦПЃЌЙЪД№АИЮЊЃКЮќЪеЮДЗДгІЕФТШЦјКЭЖўбѕЛЏСђЃЌЗРжЙПеЦјжаЕФЫЎеєЦјНјШыШ§ОБЦПЃЛ
(5)ЮЊСЫЬсИпЪЕбщЕФВњТЪЃЌПЩвдЭЈЙ§ПижЦЦјСїЫйТЪЃЌвЫТ§ВЛвЫПьЃЛИљОнSO2(g) + Cl2(g) ![]() SO2Cl2(l) ЁїH=-197.3 kJЁЄmol-1ЃЌШєШ§ОБЦПФкЮТЖШНЯИпЃЌПЩЪЪЕБНЕЮТЃЌгаРћгкЩњГЩСђѕЃТШ(SO2C12) ЃЌЙЪД№АИЮЊЃКПижЦЦјСїЫйТЪЃЌвЫТ§ВЛвЫПьЃЛШєШ§ОБЦПФкЮТЖШНЯИпЃЌПЩЪЪЕБНЕЮТЃЛ
SO2Cl2(l) ЁїH=-197.3 kJЁЄmol-1ЃЌШєШ§ОБЦПФкЮТЖШНЯИпЃЌПЩЪЪЕБНЕЮТЃЌгаРћгкЩњГЩСђѕЃТШ(SO2C12) ЃЌЙЪД№АИЮЊЃКПижЦЦјСїЫйТЪЃЌвЫТ§ВЛвЫПьЃЛШєШ§ОБЦПФкЮТЖШНЯИпЃЌПЩЪЪЕБНЕЮТЃЛ
(6) ТШЛЏбЧэП(SOC12)дкПеЦјжагіЫЎеєЦјЗЂЩњОчСвЗДгІЃЌВЂВњЩњДѓСПАзЮэЃЌТШЛЏбЧэП(SOCl2)гыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊSOCl2+H2O=SO2Ёќ+2HClЁќЃЌТШЛЏТСФмЙЛЫЎНтЩњГЩЛгЗЂадЕФТШЛЏЧтЃЌеєИЩA1C13ШмвКВЛФмЕУЕНЮоЫЎAlCl3ЃЌПЩвдгУSOC12гыAlCl3 6H2OЕФЛьКЯМгШШЃЌПЩЕУЕНЮоЫЎA1C13ЃЌЪЧвђЮЊSOCl2гыAlCl3ЁЄ6H2OжаЕФНсОЇЫЎзїгУЃЌЩњГЩЮоЫЎAlCl3МАSO2КЭHClЦјЬхЃЌВњЮяSO2КЭHClвжжЦAlCl3ЫЎНтЃЌЙЪД№АИЮЊЃКSOCl2+H2O=SO2Ёќ+2HClЁќ (9). SOCl2гыAlCl3ЁЄ6H2OжаЕФНсОЇЫЎзїгУЃЌЩњГЩЮоЫЎAlCl3МАSO2КЭHClЦјЬхЃЌВњЮяSO2КЭHClвжжЦAlCl3ЫЎНтЁЃ


 УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAБэЪОАЂЗќйЄЕТТоГЃЪ§ЃЌЯТСаа№Ъіжае§ШЗЕФЪЧЃЈ ЃЉ
A.ГЃЮТГЃбЙЯТЃЌ11.2LбѕЦјЫљКЌЕФдзгЪ§ЮЊNA
B.1.8gЕФNH4+РызгжаКЌгаЕФЕчзгЪ§ЮЊ10NA
C.ГЃЮТГЃбЙЯТЃЌ48g O3КЌгаЕФбѕдзгЪ§ЮЊ3NA
D.2.4 gН№ЪєУОБфЮЊУОРызгЪБЪЇШЅЕФЕчзгЪ§ЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЯТСадЊЫиЕФАыОЖЮЊЃК
дзг | N | S | O | Si |
АыОЖr/0-10m | 0.75 | 1.02 | 0.74 | 1.17 |
ИљОнвдЩЯЪ§ОнЃЌСздзгЕФАыОЖПЩФмЪЧ
A. 0.80ЁС10-10mB. 1.10ЁС10-10mC. 1.20ЁС10-10mD. 0.70ЁС10-10m
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаXЃЌYЃЌZШ§жждЊЫиЃЌвбжЊЂйXЃЌYЃЌZЕФЕЅжЪдкГЃЮТЯТОљЮЊЦјЬхЃЛЂкXЕЅжЪПЩдкZЕЅжЪжаШМЩеЃЌЩњГЩXZЃЌЛ№бцЮЊВдАзЩЋЃЛЂл2molX2ЗжзгПЩгы1molY2ЗжзгЛЏКЯЩњГЩ2molX2YЗжзгЃЌX2YдкГЃЮТЯТЮЊвКЬхЃЛЂмZЕЅжЪШмгкX2YжаЃЌЫљЕУШмвКОпгаЦЏАззїгУЃЛЂнЯИЬњЫПФмдкZ2жаОчСвШМЩеЃЌЧвВњЩњзиКжЩЋбЬЃЎЭЦЖЯЃК
ЃЈ1ЃЉXЃЌYЃЌZШ§жждЊЫиЕФУћГЦXY ЃЌ Z
ЃЈ2ЃЉаДГіЕФЂмЛЏбЇЗДгІЗНГЬЪНЮЊЃК ЃЎ
ЂнЕФЛЏбЇЗДгІЗНГЬЪНЮЊЃК ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаmgФГЦјЬхЃЌЫќгЩЫЋдзгЗжзгЙЙГЩЃЌЫќЕФФІЖћжЪСПЮЊMgmolЉ1 ЃЎ ШєАЂЗќйЄЕТТоГЃЪ§гУNAБэЪОЃЌдђЃК
ЃЈ1ЃЉИУЦјЬхЫљКЌдзгзмЪ§ЮЊИіЃЎ
ЃЈ2ЃЉИУЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊLЃЎ
ЃЈ3ЃЉИУЦјЬхЕФвЛИіЗжзгЕФжЪСПЮЊgЃЎ
ЃЈ4ЃЉИУЦјЬхШмгкЫЎКѓаЮГЩVLШмвКЃЌЦфШмвКЕФЮяжЪЕФСПХЈЖШЮЊ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯрЭЌЬхЛ§ЕФpHЃН3ЕФЧПЫсШмвККЭШѕЫсШмвКЗжБ№ИњзуСПЕФУОЭъШЋЗДгІЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ШѕЫсШмвКВњЩњНЯЖрЕФЧтЦј
B. ЧПЫсШмвКВњЩњНЯЖрЕФЧтЦј
C. СНепВњЩњЕШСПЕФЧтЦј
D. ЮоЗЈБШНЯСНепВњЩњЧтЦјЕФСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖэТоЫЙЖХВМФЩКЫбаОПСЊКЯПЦбаЫљКЭУРЙњРЭТзЫЙРћИЅФЊЖћЙњМвЪЕбщЪвКЯзїЃЌКЯГЩСЫЗХЩфадЮоЫиуW(293116Lv)ЃЌИУКЫЫиЕФжазгЪ§ЮЊ
A. 116 B. 293 C. 409 D. 177
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТЭМБэЪОЯђ10mLpH=3ЕФAШмвКжаМгЫЎЯЁЪЭЕНV1mLШмвКpHЕФБфЛЏЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ

A. ШєV1=100ЃЌдђЯЁЪЭЧАAЕФХЈЖШвЛЖЈЪЧ0.001mol/L
B. aЕуЫЎЕФЕчРыГЬЖШвЛЖЈаЁгкbЕу
C. ШєAЮЊNH4ClКЭHClЕФЛьКЯШмвКЃЌдђV1вЛЖЈДѓгк100
D. ШєAЮЊNH4ClКЭNH3ЁЄH2OЕФЛьКЯШмвКЃЌдђШмвКжаc(NH4+)>c(Cl-)>c(H+)>c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдПЩФцЗДгІ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
4NO(g)+6H2O(g)ЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
A. ШєЕЅЮЛЪБМфФкЩњГЩxmolNOЕФЭЌЪБЃЌЯћКФxmolNH3ЃЌдђЗДгІДяЕНЦНКтзДЬЌ
B. ДяЕНЛЏбЇЦНКтЪБ4vе§(O2)=5vФц(NO)
C. ДяЕНЛЏбЇЦНКтЪБЃЌШєдіДѓШнЦїШнЛ§ЃЌдђе§ЗДгІЫйТЪМѕаЁЃЌФцЗДгІЫйТЪдіДѓ
D. ЛЏбЇЗДгІЫйТЪЙиЯЕЃК2vе§(NH3)=3vе§(H2O)
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com