
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
分析 W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,则W为第二周期元素,X、Y、Z为第三周期元素,且X为Na或Mg或Al,W为O时Z为S,W为F时Z为Cl,相对位置为 ,
,
A.W为O或F时无正价;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小;
C.W为O时,Y为Si,则非金属性W>Y;
D.若W与X原子序数差为5,W为N时X为Mg,或W为O时X为Al.
解答 解:W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,则W为第二周期元素,X、Y、Z为第三周期元素,且X为Na或Mg或Al,W为O时Z为S,W为F时Z为Cl,相对位置为 ,
,
A.W为O或F时无正价,则W不存在含氧酸,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X>Y>Z>W,故B正确;
C.W为O时,Y为Si,则非金属性W>Y,则W的气态氢化物的稳定性大于Y的气态氢化物的稳定性,故C错误
D.若W与X原子序数差为5,W为N时X为Mg,或W为O时X为Al,形成化合物的化学式为Mg3N2或Al2O3,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素的相对位置及不确定性,选项D为解答的易错点,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:实验题
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
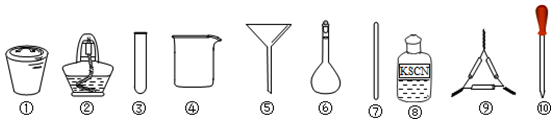
| A. | 将茶叶灼烧灰化,选用①、②、⑦和⑨ | |
| B. | 用浓硝酸溶解茶叶并加蒸馏水稀释,选用③和⑩ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验中滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯甲酸( 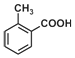 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
| C. | 有机物 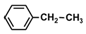 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
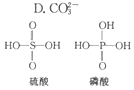 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )| A. | 硫酸和磷酸都是强酸 | B. | 硫酸的酸性比磷酸弱 | ||
| C. | 磷酸和硫酸都是弱酸 | D. | 硫酸的酸性比磷酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
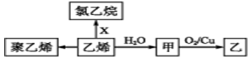
| A. | 甲与CH3OCH3互为同分异构体 | B. | X为Cl2 | ||
| C. | 聚乙烯是纯净物 | D. | 甲→乙反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com