
| A. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
分析 A.苯酚无强氧化性;
B.氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀;
C.碱不能除去烃类化合物;
D.氢氧化镁在380℃时,分解放出水蒸气和耐高温的固体氧化镁.
解答 解:A.苯酚的水溶液可使菌体蛋白变性杀菌消毒,但苯酚无强氧化性,故A错误;
B.氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀,加快铝腐蚀,故B错误;
C.矿物油渍属于烃类化合物,碱和烃类化合物不反应,所以不能用纯碱除去矿物油渍,故C错误;
D.阻燃物质原理有三个:清除可燃物、隔绝氧气或空气、使可燃物的温度降到着火点以下,三者具其一即可,氢氧化镁在380℃时分解,方程式为:Mg(OH)2 $\frac{\underline{\;高温\;}}{\;}$MgO+H2O↑.氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故D正确;
故选:D.
点评 本题考查较综合,涉及元素化合物性质的综合考查,明确物质的性质是解题关键,题目难度不大.注意C中矿物油渍和植物油油渍的区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是 2,5,5-三甲基-3-乙基庚烷 的名称是 2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将 与NaOH的醇溶液共热可制备 CH3-CH═CH2 与NaOH的醇溶液共热可制备 CH3-CH═CH2 | |
| C. | 向柠檬醛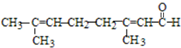 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
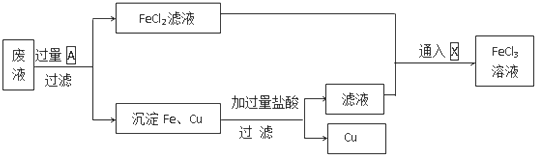
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol | |
| B. | 若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) | |
| C. | 若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 | |
| D. | KNO3的氧化性强于N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的AlCl3溶液中含有Al3+离子数为0.1NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应后可得到NH3为1NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:1:3 | C. | 1:3:1 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 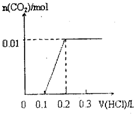 | B. | 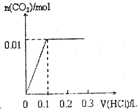 | C. | 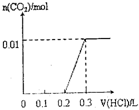 | D. | 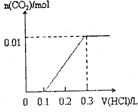 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
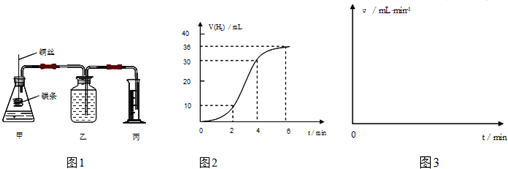
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com