
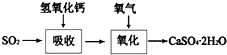
分析 (1)根据平衡常数的定义书写表达式为:K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$,根据V=$\frac{△c}{△t}$计算速率;
(2)增大浓度、升高温度、增大压强、加入催化剂均能加快化学反应速率;
(3)A.平衡前,随着反应的进行,气体的物质的量减小,故容器内压强始会减小;
B.温度为变量,当容器内温度不再变化时,反应达到了平衡;
C.平衡时,其他条件不变,升高温度平衡正向移动,可增大平衡常数;
D.反应热效应与催化剂无关;
(4)依据PH和离子积常数计算溶液中氢氧根离子浓度结合钠离子浓度计算比值;依据溶液中质子守恒分析书写离子浓度关系;
(5)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)根据平衡常数的定义书写表达式为:K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$,2L容器中,10分钟内,气体密度减小了8g/L,则减少的S为0.25mol/L,变化的CO的浓度为0.5mol/L,故CO的反应速率是0.05mol/(L﹒min),故答案为:$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$;0.05mol/(L﹒min);
(2)a.减压,减小速率,故错误;
b.增加SO2的浓度,加快反应速率,故正确;
c.升温,加快反应速率,故正确;
d.及时移走产物,相对于减小浓度,减小反应速率,故错误;
故答案为:bc;
(3)若反应在恒容的密闭容器中进行,SO2(g)+2CO(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2CO2(g)+S(l)+Q (Q>0),
A.平衡前,随着反应的进行,气体的物质的量减小,故容器内压强始会减小,故错误;
B.温度为变量,当容器内温度不再变化时,反应达到了平衡,故正确;
C.平衡时,其他条件不变,升高温度平衡正向移动,可增大平衡常数,故正确;
D.反应热效应与催化剂无关,故错误;
故答案为:BC;
(4)常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,亚硫酸根离子水解溶液呈碱性;该溶液中c(Na+)=0.2mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,该溶液中c(Na+)与c(OH-)之比=10-6mol/L:0.2mol/L=2×105 :1;常温下0.1mol/L Na2SO3溶液,该溶液中存在质子守恒,c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故答案为:2×105;c(HSO3-)+2c(H2SO3);
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
B.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
C.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
计算分析吸收二氧化硫理论吸收量由多到少的顺序是B>C=D>A,
故答案为:B>C=D>A.
点评 本题考查了化学反应速率与化学平衡、盐类水解分析应用,电解质溶液中离子浓度大小比较依据和方法,物质性质的理解应用,注意吸收二氧化硫的最大量反应判断,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 铜与浓硫酸反应产生二氧化硫,而锌与浓硫酸反应产生氢气 | |
| C. | 二氧化硅是酸性氧化物能和烧碱溶液反应 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
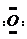 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
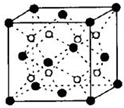 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
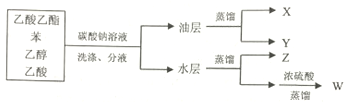
| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


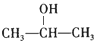 +NaCl;
+NaCl;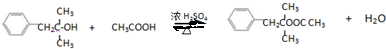 ;
;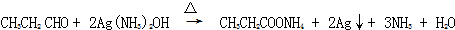 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com