
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
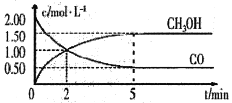
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
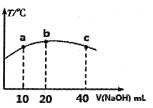
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
【答案】0.6 AB 3 -342.5 kJ·mol-1 AB Fe(OH)3-3e-+5OH-= FeO42-+4H2O ②③
【解析】
(1)①根据速率定义式求算。
② A.根据三段式求算。
B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变。
C. 达到平衡后,再充入氩气,总压增大分压不变,速率不变。
D.2min前后反应未达到平衡状态,反应正向进行,υ(正)>υ(逆)。
③根据平衡常数K=c(CH3OH)/[c(CO)c2(H2)]求算。
(2)①根据盖斯定律求算。
②2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移。
CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移。
(3)充电时阳极上失去电子发生氧化反应。
(4)①②HNO2是弱酸,亚硝酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放热最多,根据此确定c(NaOH)。
③电离是吸热,温度越高电离平衡常数越大。
④当c(NaOH)较大时,可能出现c(Na+)>c(OH-) >c(NO2-)>c(H+)。
(1)①从反应开始至达到平衡,υ(CO)=(1.5mol/L)/5min=0.3mol/(Lmin),υ(H2)= 2υ(CO)=0.6 mol/(L·min),故答案为:0.6。
② A. CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起(mol) 2 4 0
转(mol) 1.5 3 1.5
平(mol) 0.5 1 1.5
达到平衡时,CO的转化率为(1.5mol÷2mol)×100%=75%,故A正确;
B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,故B正确;
C. 达到平衡后,再充入氩气,总压增大分压不变,速率不变,故C错误;
D.2min前后反应未达到平衡状态,反应正向进行,υ(正)>υ(逆),故D错误;
故选AB。
③该条件下反应的平衡常数K=c(CH3OH)/c(CO)c2(H2)= 1.5/(0.5×12)=3,故答案为:3。
(2)①I.根据CO的燃烧热为△H=-283.0kJ·mol-1,得出CO(g)+1/2O2(g)= CO2(g) △H=-283.0kJ·mol-1①,
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1,②
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1③
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1③
根据盖斯定律,①-②+③得到2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l),△H=-342.5 kJ·mol-1,故答案为:-342.5 kJ·mol-1。
CH3OCOOCH3(g)+ H2O( l),△H=-342.5 kJ·mol-1,故答案为:-342.5 kJ·mol-1。
②2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移,
CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移,
A. 降低体系的温度,平衡右移,故A正确;
B. 压缩容器的体积,相当于增大压强,平衡右移,故B正确;
C.水的浓度是个定值,故C错误;
D. 催化剂只能改变反应速率,不能使平衡移动,故D错误;
故选AB。
(3)高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO
3Zn+2K2 FeO
(4)①HNO2是弱酸,亚硝酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放热最多,c(NaOH)=(0.02L×0.01mol/L)/0.02L=0.01mol/L,故①错误,②正确;
③电离是吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当c(NaOH)较大时,可能出现c(Na+)>c(OH-) >c(NO2-)>c(H+),故④错误;
故选②③。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】(1)已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是___________ (填序号)
①正反应速率一定大于逆反应速率
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
(2)下列溶液:①pH=1的盐酸,②0.05 molL-1的盐酸溶液 ③0.1molL-1的氯化钠溶液 由水电离的H+浓度由大到小顺序是___________(填序号)
(3)在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1. 该溶液的pH可能为_________________
(4)有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是______________________
(5)一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是
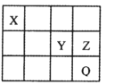
A. 简单离子半径(r):r(Q)>r(Y)>r(Z)
B. 氧化物对应的水化物的酸性:Z>Y
C. XY2和XZ4均含有非极性共价键
D. 标准状况下Z的单质状态与Q的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体 ②液态HCl ③CO2 ④汞 ⑤CaCO3固体 ⑥稀硫酸 ⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水
其中属于混合物的是(填序号,下同)___;属于电解质的是___;属于非电解质的是___;能导电的有____。
(2)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
①将1mol·L-1的FeCl3 溶液逐滴滴入沸水中,液体变为__色,得到的是Fe(OH)3胶体;反应的化学方程式为____。
②怎样证明制得的物质是胶体?请简述操作过程:____。
③取少量制得的胶体加入试管中,再加入少量NaCl溶液,观察到的现象是__,这种现象称为胶体的____。
④Fe(OH)3胶体能稳定存在的主要原因是___(填序号)。
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶体离子作无规则运动(即布朗运动) D.胶粒能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
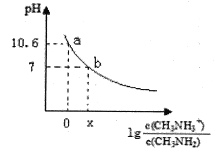
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用如图所示仪器和药品来制取纯净的无水氯化铜(Cu+Cl2![]() CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
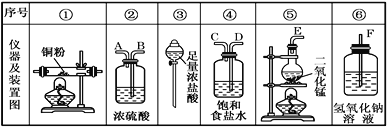
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接_____接_______接_______接______接______,其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是________接________。
(2)装置②的作用是_______________________________________________________;
装置④的作用是__________________________________________________________。
(3)实验开始时,应首先检验装置的________,实验结束时,应先熄灭________处(填装置序号) 的酒精灯。
(4)在装置⑥的广口瓶中,发生反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又称为抗坏血酸,在人体内有重要功能。其结构简式如图。
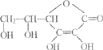
请回答下列问题:
(1)维生素C的分子式为_________,维生素C可以治疗的疾病是___________
A.坏血病 B.脑炎 C.骨折 D.肺炎
(2)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是______、_______;
(3)铁是人体必需微量元素中含量最多的一种,食物中的Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素C体现____________(填“氧化”或“还原”)性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com