
 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;分析 R和L是同主族元素,R的最外层电子数比次外层电子数少1,R为Li或Cl,L的单质常温常压下是紫黑色固体,应为I2,则R为Cl,L为I元素,Q和X形成的离子化合物XQ是碱石灰的主要成分,可知Q为O元素,X为Ca元素,X、Y、Z位于同一周期,为第四周期,Y的外围电子数是最外层电子的6倍,外围电子排布为3d54s1,应为Cr元素,Z位于ds区且不能和稀硫酸反应生成H2,应为Cu,以此解答该题.
解答 解:R和L是同主族元素,R的最外层电子数比次外层电子数少1,R为Li或Cl,L的单质常温常压下是紫黑色固体,应为I2,则R为Cl,L为I元素,Q和X形成的离子化合物XQ是碱石灰的主要成分,可知Q为O元素,X为Ca元素,X、Y、Z位于同一周期,为第四周期,Y的外围电子数是最外层电子的6倍,外围电子排布为3d54s1,应为Cr元素,Z位于ds区且不能和稀硫酸反应生成H2,应为Cu,
(1)L为I元素,最外层有7个电子,价层电子轨道示意图为 ,I的含氧酸HIO3中I形成3个δ键,且有1个孤电子对,为sp3杂化,酸根IO3-的离子构型为三角锥形,
,I的含氧酸HIO3中I形成3个δ键,且有1个孤电子对,为sp3杂化,酸根IO3-的离子构型为三角锥形,
故答案为: ;sp3;三角锥形;
;sp3;三角锥形;
(2)CuCl42-的配体为Cl-,稀溶液中主要形成[Cu(H2O)4]2+配离子,CuCl2的稀溶液是浅蓝色,
故答案为:Cl-;稀溶液中主要形成[Cu(H2O)4]2+配离子;
(3)由限链状结构结构可知每个Cr对应的O原子个数为2+2×$\frac{1}{2}$=3,氧化物为CrO3,故答案为:CrO3;
(4)铜晶胞中铜原子位于顶点和面心,即晶胞类型为面心立方堆积,铜原子半径为r,则晶胞边长=2$\sqrt{2}$r,晶胞体积V=(2$\sqrt{2}$r)3,每个晶胞中铜原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则空间利用率为$\frac{\frac{4}{3}×π}{(2\sqrt{2})^{3}}$×100%=74%,
己知X原子半径约为200pm,
则ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{256}{{N}_{A}}}{(2\sqrt{2}×200×1{0}^{-10})^{3}}$g/cm3=1.5g/cm3,
故答案为:74%;1.5;
(5)XL2晶体含有层状结构,其层内有强极性共价键,层外有范德华力相连接,则XL2的晶体类型是混合型晶体或过渡型晶体,
故答案为:混合型晶体或过渡型晶体.
点评 本题考查了物质结构及其性质,涉及原子杂化方式的判断、价电子排布式的书写、元素周期律、晶胞的计算等知识点,题目综合性较强,注意根据价层电子对互斥理论、构造原理等知识来分析解答,题目难度大.


科目:高中化学 来源: 题型:解答题
 .
. .
. .
. .
. :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强不再随时间而改变时 | |
| B. | 混合气体中各组成成分的含量不再改变时 | |
| C. | 气体的总质量不再改变时 | |
| D. | 单位时间内消耗1 mol I2,同时有2 mol HI生成时 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的核电荷数依次增多 | B. | 原子核外电子层数依次增多 | ||
| C. | 原子核外次外层电子数依次增多 | D. | 原子量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
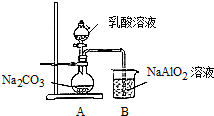
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
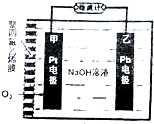 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
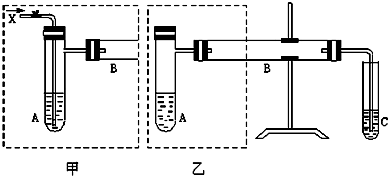
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com