(2013?达州模拟)NaClO和KAl(SO
4)
2都是重要的化工产品,均可应用于造纸业.
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH
大于
大于
7(填大于、小于、等于);其原因是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示)
(2)KAl(SO
4)
2溶液中质子守恒等式为
c(H+)=c(OH-)+3c(Al(OH)3)
c(H+)=c(OH-)+3c(Al(OH)3)
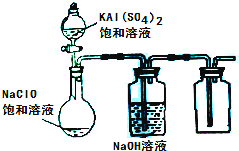
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO
4)
2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO
4)
2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为
3Cl-+Al3++3H2O=3HClO+Al(OH)3↓
3Cl-+Al3++3H2O=3HClO+Al(OH)3↓
.②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是
.
(4)若将分液漏斗中的KAl(SO
4)
2溶液换成硫酸亚铁铵(一种复盐:(NH
4)
2SO
4?FeSO
4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
.
(5)取100mL 0.1mol/L Ba(OH)
2溶液,向其中逐滴加入同浓度的KHSO
4溶液至Ba
2+恰好完全沉淀,此时溶液的PH值为
10.7
10.7
(忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10
-12)

 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.

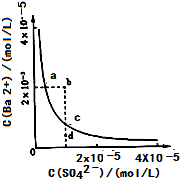 (2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )