
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
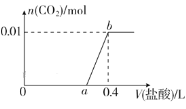
A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
【答案】B
【解析】
向NaOH和Na2CO3混合配成的溶液中滴加盐酸时,先发生氢氧化钠与盐酸的中和反应:NaOH+HCl=NaCl+H2O,氢氧化钠反应完毕后再发生碳酸钠与盐酸的反应:HCl+Na2CO3=NaHCO3+NaCl,最后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,利用物质的量的关系并结合图象分析解答。
A.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠:NaOH+HCl=NaCl+H2O,继续滴加时,盐酸与Na2CO3首先发生反应:HCl+Na2CO3=NaHCO3+NaCl,不放出气体,继续滴加时发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,则在0-a范围内发生反应为:NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl,故A错误;
B.根据图像可知,从a点开始发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,该过程中消耗氯化氢的物质的量与生成二氧化碳的物质的量相等为0.01mol,则消耗0.1molL-1稀盐酸的体积分别为![]() =0.1L,所以a=0.4-0.1=0.3,故B正确;
=0.1L,所以a=0.4-0.1=0.3,故B正确;
C.根据分析可知,ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故C错误;
D.根据碳元素守恒,混合物中碳酸钠的物质的量是0.01mol,b点消耗盐酸的物质的量为0.1mol/L×0.4L=0.04mol,则a点氯化氢的物质的量为:0.04mol-0.01=0.03mol,根据反应HCl+Na2CO3=NaHCO3+NaCl可知,0.01mol碳酸钠消耗0.01mol氯化氢生成碳酸氢钠,则氢氧化钠的物质的量为0.03mol-0.01mol=0.02mol,所以原混合溶液中NaOH与Na2CO3的物质的量之比为0.02mol∶0.01mol=2∶1,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,如图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓。如图②是电解法除去工业废水中的Cr2O72-,下列说法正确的是( )
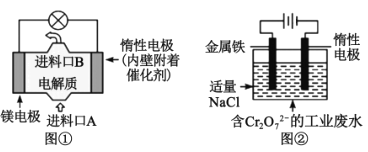
A.图①中镁电极发生的反应是:ClO-+H2O+2e-=Cl-+2OH-
B.图②最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-3e-=Fe3+
C.图②中每转移0.2mol电子,阴极逸出2.24LH2
D.若图①中7.2gMg溶解产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g) +B(g)![]() 2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
A. 用物质A表示的反应平均速率为0.6 mol·L-1·s-1
B. 用物质B表示的反应的平均速率为0.3 mol·L-1·s-1
C. 2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A. -488.3 kJ·mol-1 B. -191 kJ·mol-1
C. -476.8 kJ·mol-1 D. -1 549.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇钡铜氧、汞钡铜氧、汞钡钙铜氧等都是常见的高温超导体。回答下列问题:
(1)钇(39Y)是一种重要的稀土金属,基态Y原子的价电子排布式为______。下列科学家中,在稀土化学领域做出重要贡献的是_________(填标号)。
a.侯德榜 b.屠呦呦 c.徐光宪
(2)BaCO3可用于制备上述高温超导体,其3种组成元素中,第一电离能最大的是______(填元素符号),CO32-的空间构型为________,其中碳原子的杂化方式为________________。
(3)汞钡铜氧晶体的晶胞如下图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。
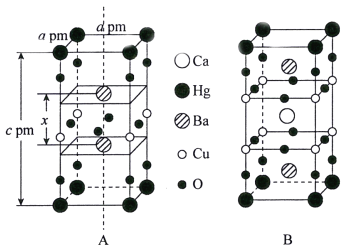
汞钡铜氧晶体的密度为______g·cm-3(设NA为阿伏加德罗常数的值)。图A晶胞中钡离子的分数坐标为(![]() )和_________。掺杂Ca2+所得超导材料的化学式为_________。
)和_________。掺杂Ca2+所得超导材料的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 mol·L-1 NaOH溶液滴定10 mL 0.100 mol·L-1 H3PO4溶液,曲线如图所示。下列说法正确的是
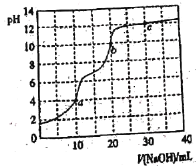
A.滴定终点a可选择酚酞作指示剂
B.c点溶液中c(Na+)>3c(PO43-)+2c(HPO42-)+c(H2PO4-)
C.b点溶液中c(HPO42-)>c(PO43-)>c(H2PO4-)
D.a、b、c三点中水的电离程度最小的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com