
 ���ຬ̼��������������Ҫ�Ļ���ԭ�ϣ�
���ຬ̼��������������Ҫ�Ļ���ԭ�ϣ����� ��1��C2O3��һ����ɫ��ζ�����壬������ˮ���ɲ��ᣨH2C2O4����������NaOH��Һ��Ϸ�������кͷ�Ӧ�����κ�ˮ��
��2����ѧ��C��O��O=O��C=O�ļ��ֱܷ�Ϊ958.5kJ•mol-1��497kJ•mol-1��745kJ•mol-1����CO��g��+$\frac{1}{2}$O2��g���TCO2��g������ʽ����H2�T958.5kJ•mol-1+$\frac{1}{2}$��497kJ•mol-1-2��745kJ•mol-1=-283kJ•mol-1��
��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H1=-198kJ•mol-1
��CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H2=-283kJ•mol-1
��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H3=-846.3kJ•mol-1����-�١�3-�ڵã�CH4��g��+H2O��g��?CO��g��+3H2��g���ġ�H=30.7kJ•mol-1��
��3���������ߢ�������ǽ��仯һ�����������������ߢ�ﵽƽ������ʱ���٣�˵����Ӧ���ʿ죬����������Ũ�ȴ�ƽ��������У��ı����������£�
�����ߢ��Ӧ��Ӧ��ƽ�ⳣ��=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��������м�����ʽ����ƽ��Ũ�ȼ���õ������������ʵ���Ũ�ȵ�CH4��H2O��CO��H2����ڸ������У������ʱŨ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
�����ߢ���������ߢﵽƽ������ʱ��̣���Ӧ���ʿ죬����Ũ�ȼ�С˵��ƽ��������У�
��� �⣺��1��C2O3��һ����ɫ��ζ�����壬������ˮ���ɲ��ᣨH2C2O4����������NaOH��Һ��Ϸ�������кͷ�Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��C2O3+2NaOH�TNa2C2O4+H2O��
�ʴ�Ϊ��C2O3+2NaOH�TNa2C2O4+H2O��
��2����ѧ��C��O��O=O��C=O�ļ��ֱܷ�Ϊ958.5kJ•mol-1��497kJ•mol-1��745kJ•mol-1����CO��g��+$\frac{1}{2}$O2��g���TCO2��g������ʽ����H2�T958.5kJ•mol-1+$\frac{1}{2}$��497kJ•mol-1-2��745kJ•mol-1=-283kJ•mol-1��
��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H1=-198kJ•mol-1
��CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H2=-283kJ•mol-1
��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H3=-846.3kJ•mol-1����-�١�3-�ڵã�CH4��g��+H2O��g��?CO��g��+3H2��g���ġ�H=30.7kJ•mol-1��
�ʴ�Ϊ��30.7kJ•mol-1��
��3���������ߢ�������ǽ��仯һ�����������������ߢ�ﵽƽ������ʱ���٣�˵����Ӧ���ʿ죬����������Ũ�ȴ�ƽ��������У��ı����������£�a��b�����a���¶�С��b�㣬������COŨ�ȱ仯��ʾ�ķ�Ӧ���ʹ�ϵΪa��b��
�ʴ�Ϊ�����£�a��b��
�ڽ�����м�����ʽ����ƽ��Ũ�ȼ���õ���ͼ���п�֪�ﵽƽ��״̬����Ũ��Ϊ3mol/L��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����mol/L�� 1.5 2 0 0
�仯����mol/L�� 1 1 1 3
ƽ������mol/L�� 0.5 1 1 3
���ߢ��Ӧ��Ӧ��ƽ�ⳣ��=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$=$\frac{{3}^{2}��1}{0.5��1}$=54��
���������ʵ���Ũ�ȵ�CH4��H2O��CO��H2����ڸ������У������ʵ���Ũ��Ϊc�������ʱŨ����Qc=$\frac{{c}^{3}��c}{c��c}$=c2����ƽ�ⳣ�����Ƚϴ�С�����Է�Ӧ���з�����ȷ������ʼʱH2���������ʺ���������������ȷ����
�ʴ�Ϊ��54����ȷ����
�����ߢ���������ߢﵽƽ������ʱ��̣���Ӧ���ʿ죬����Ũ�ȼ�С˵��ƽ��������У�
a�������¶ȷ�Ӧ���ʼ�С���ﵽƽ��ʱ������a����
b��ʹ�ô����ӿ췴Ӧ���ʡ������¶�ƽ��������У�����Ũ�ȼ�С����b��ȷ��
c����ѹ����ѹ�����������ѹ����ƽ�ⲻ�䣬��c����
�ʴ�Ϊ��b��
���� ���⿼����������ԭ��Ӧ���Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�á��ʱ�ļ��㡢��Ӧ���ʺͻ�ѧƽ��Ӱ�����ط����жϡ�ע��ͼ�����߱仯�������ͻ�ѧƽ���ƶ�ԭ��������Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Ȼ��ȼ�� | B�� | Ũ���ᵹ��ˮ�� | ||
| C�� | ��������ԭ����ͭ | D�� | ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
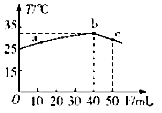 25��ʱ����ʢ��50mLpH=2��һԪ��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
25��ʱ����ʢ��50mLpH=2��һԪ��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | a��b�Ĺ����У���Һ��c��A-����c��HA��֮��ʼ�ղ��� | |
| B�� | c���ʾ���ǡ����ȫ��Ӧ | |
| C�� | 25��ʱ��HA�ĵ���ƽ�ⳣ��KaԼΪ1.43��10-3 | |
| D�� | ��Ũ�ȵ�NaOH��NaA �����Һ��һ�����ڹ�ϵ��c��Na+����c��A-����c��OH-������H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
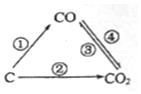 �������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�
�������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1���������������������������Ҫԭ��֮һ���������������ж��ַ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +1 | B�� | +2 | C�� | +3 | D�� | +5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯī | B�� | �մ� | C�� | ��ͭ | D�� | ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 48% | B�� | 42% | C�� | 26% | D�� | 24% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com