
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 11种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-和Cl2均有毒 | B. | Cl-和Cl2均呈黄绿色 | ||
| C. | 相比较,Cl-稳定,Cl2活泼 | D. | Cl-和Cl2均能与金属单质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
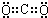
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 此反应为放热反应 | |
| B. | 此反应只有达到平衡时,密闭容器中的压强才不会变化 | |
| C. | 此反应达到1 000℃时的反应速率比700℃时大 | |
| D. | 该反应的化学平衡常数越大,反应物的转化率越低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放热反应中,旧键断裂需要的能量比新键形成放出的能量多 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 一个化学反应的能量变化只与反应物的用量有关,与各物质的状态无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | 结合质子(H+)的能力由强到弱的顺序是AlO${\;}_{2}^{-}$>OH->CO${\;}_{3}^{2-}$ | |
| D. | 反应Ⅰ、Ⅱ均为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com