
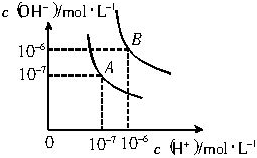
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.分析 (1)结合图示根据水的离子积表达式Kw=c(H+)•c(OH-)及氢氧根离子浓度计算出25℃时和100℃水的离子积;
(2)先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比;
(3)根据溶解度和密度计算氢氧化钙的物质的量浓度,根据氢氧化钙和钙离子、氢氧根离子之间的关系式计算钙离子浓度、氢氧根离子浓度,再结合离子积常数公式计算离子积;
(4)根据H20?H++OH-可知,H2SO4溶液、Ba(OH)2溶液抑制水的电离,根据溶液的H2SO4溶液的PH或Ba(OH)2溶液中c(OH-)计算水的电离的物质的量,Na2S溶液、NH4NO3溶液促进水的电离,根据PH可直接求出发生电离的水的物质的量,进而计算物质的量之比;
(5)上述溶液中,不考虑阴离子的电离和水解时阴离子浓度相同,从水解角度分析;
(6)①由HA-?H++A2-可知,Na2A为强碱弱酸盐;
②根据电荷守恒及酸根离子的水解分析判断.
解答 解:(1)A点25℃时,c(H+)=c(OH-)=1×10-7mol/L,Kw=c(H+)•c(OH-)=1×10-7×1×10-7=10-14;
100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)•c(OH-)=1×10-6×1×10-6=10-12,
故答案为:10-14;10-12;
(2)25℃时,pH=10的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,
c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L,解得x:y=2:9,故答案为:2:9;
(3)若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,则100g水中溶解0.74g氢氧化钙时氢氧化钙的C=$\frac{\frac{0.74g}{74g/mol}}{\frac{100g+0.74g}{1g/mol}}$=0.1mol/L,氢氧化钙是强电解质,所以C(Ca(OH)2)=C(Ca 2+ )=0.1mol/L,C(OH-)=2C(Ca(OH)2)=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=C(Ca 2+ ).C(OH-)2=0.1mol/L×(0.2mol/L)2=4×10-3(mol/L)3,故答案为:4×10-3;
(4)设溶液的体积为1L,
①中pH=0的H2SO4中c(H+)=1.0 mol•L-1,c(OH-)=1.0×10-14mol•L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol•L-1,c(H+)=1.0×10-13mol•L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol•L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol•L-1,水的电离的物质的量为1.0×10-5mol;
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,故答案为:1:10:1010:109;
(5)上述溶液中,不考虑阴离子的电离和水解时阴离子浓度相同,都是0.1mol/L,硫酸根离子和氯离子不水解,浓度不变,碳酸氢根离子水解和电离后,阴离子浓度不变,碳酸根离子水解时,1mol碳酸根离子生成2mol阴离子,碳酸氢根离子和氢氧根离子,所以阴离子的总物质的量最大的是Na2CO3溶液,故答案为:②;
(6)①由HA-?H++A2-可知,Na2A为强碱弱酸盐,A2-水解显碱性,水解离子反应为A2-+H2O?HA-+OH-,由H2A=H++HA-可知,NaHA只电离不水解,所以溶液显酸性,
故答案为:碱性;酸性;
②钠离子不水解,所以浓度最大,A2-虽然能水解但较微弱,氢氧根离子有利于水的电离和A2-的水解,所以氢氧根离子浓度大于HA-,溶液呈碱性则氢离子浓度最小,所以离子浓度大小顺序是:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故答案为:A.
点评 本题考查水的离子积常数、弱电解质的电离、盐类水解及离子浓度大小的比较,明确习题中的信息是解答本题的关键,注意二元酸的两步电离特点,为易错点.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
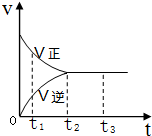 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )| A. | t1时,只有正反应在进行 | |
| B. | t2~t3时间段,反应停止 | |
| C. | t2时,容器内有1.5mol Y | |
| D. | t2~t3时间段,X,Y的物质的量均没有发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K的相对原子质量比较大 | |
| B. | K可失的电子数较多 | |
| C. | K含有的电子数较多 | |
| D. | K和Na最外层电子数相同,但钾原子的半径较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体氯化钠溶于水 | B. | 氯化氢溶于水 | ||
| C. | 冰经加热变成水蒸气 | D. | 氯化铵受热分解生成氯化氢和氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
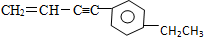 ,下列有关其结构的说法正确的是( )
,下列有关其结构的说法正确的是( )| A. | 所有碳原子可能在同一平面上 | B. | 最多有11个碳原子在同一平面上 | ||
| C. | 最多有5个碳原子在同一直线上 | D. | 最多有7个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+═H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的来源:2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com