
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
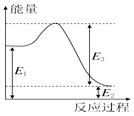 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
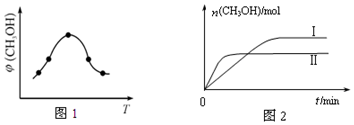
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |
| Y | Z |
| A. | 若 X 通过共用三对电子可形成 X2 分子,Z 在周期表中的位置是第三周期Ⅵ族 | |
| B. | 若 X、Y、Z 都是金属,则它们的最高价氧化物的水化物都是强碱 | |
| C. | 若它们原子最外层电子数之和为 13,则它们均为非金属元素 | |
| D. | 若 X、Y、Z 都是非金属,则三者形成的简单氢化物中,Z 的氢化物沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
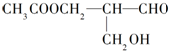 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与新制的氢氧化铜作用 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI被氧化成KOH | |
| B. | KI是离子化合物,I2是共价化合物 | |
| C. | 1 mol O3 在反应中得到4 mol 电子 | |
| D. | KOH中既有离子键又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com