
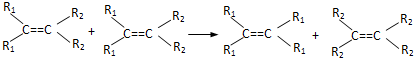
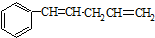 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )| A. | 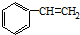 | B. | 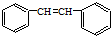 | C. | CH2=CHCH3 | D. | 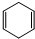 |
分析 根据题所给信息烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃解题,对于有机物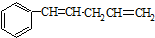 发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂或C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂或两种断裂情况同时发生C6H5CH与═CHCH2CH与═CH2发生在双键位置的断裂,断裂后的基团进行组合重新形成双键.
发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂或C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂或两种断裂情况同时发生C6H5CH与═CHCH2CH与═CH2发生在双键位置的断裂,断裂后的基团进行组合重新形成双键.
解答 解:因烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃,对于有机物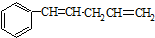 发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂,可形成C6H5CH═CHCH2CH=CHCH2CH═CHC6H5、CH2═CH2,C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂,可形成C6H5CH=CHC6H5故B正确,CH2═CHCH2CH═CHCH2CH═CH2、两种断裂情况同时发生可形成C6H5CH═CH2故A正确,、═CHCH2CH═与═CHCH2CH═,可以生成
发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂,可形成C6H5CH═CHCH2CH=CHCH2CH═CHC6H5、CH2═CH2,C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂,可形成C6H5CH=CHC6H5故B正确,CH2═CHCH2CH═CHCH2CH═CH2、两种断裂情况同时发生可形成C6H5CH═CH2故A正确,、═CHCH2CH═与═CHCH2CH═,可以生成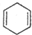 故D正确,不可能生成的产物是CH2=CHCH3,
故D正确,不可能生成的产物是CH2=CHCH3,
故选C.
点评 本题考查同分异构体,读懂题目所给的信息是解题的关键,可以是同种分子,也可以是不同分子发生“复分解反应”,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
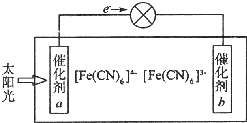 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
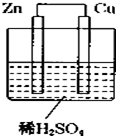 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )| A. | ②④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种蛋白质为人工合成的高分子化合物 | |
| B. | 这种蛋白质遇到HgCl2的浓溶液将发生盐析 | |
| C. | 这种蛋白质能完全水解生成单糖分子 | |
| D. | 这种蛋白质分子中存在“-CONH-”的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

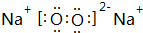 ,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为
,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为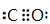 、
、 ;
;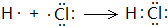 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO2↑+14H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com