
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具![]() 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是![]()
![]()
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5mol
C.每生成1molFe3O4,反应转移的电子为4mol
D.O2是氧化剂,S2O32-与Fe2+是还原剂
【答案】A
【解析】
从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂,以此解答该题。
A. 参加反应的氧化剂与还原剂的物质的量之比为1:(2+2)=1:4,故A错误;
B.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为![]() 14mol,所以有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为0.5mol,故B正确;
14mol,所以有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为0.5mol,故B正确;
C. 反应3Fe2+ + 2S2O32-+O2 +xOH-= Fe3O4↓+S4O62-+ 2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故C正确;
D.S2O32-到S4O62-,S元素的化合价升高,S2O32-和部分的Fe2+是还原剂,氧气是氧化剂,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】“纳米小人”(NanoPutians”)是莱斯大学的StephanieH.Chanteau和JamesM.Tour创造出来的小家伙。他们不仅设计出了一系列2nm大小的迷你小人分子,而且还真的把它们合成了出来。如图是其中的一种,下列说法正确的是( )
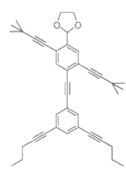
A.如图“纳米小人”含苯环,属于芳香烃
B.如图“纳米小人”所有碳原子可能共平面
C.如图“纳米小人”含有三种官能团
D.如图“纳米小人”能发生加成反应、取代反应、氧化反应、还原反应等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物的说法正确的是( )
A.用浓硫酸和乙醇在加热条件下制备乙烯,应该迅速升温到140℃
B.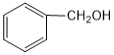 与
与 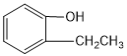 互为同系物
互为同系物
C.冬天汽车里用的防冻液是乙醇
D.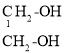 CH3CH2OH CH3CH2CH3三者沸点、溶解度依次降低
CH3CH2OH CH3CH2CH3三者沸点、溶解度依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
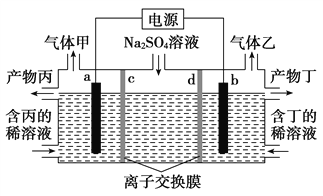
A. a极与电源的负极相连
B. 产物丙为硫酸
C. 离子交换膜d为阴离子交换膜
D. a电极反应式:2H2O+2e-===H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
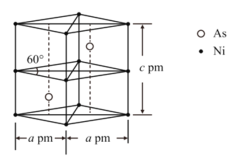 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH____NaOH溶液的pH(填“>”“=”或“<”)。
(2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积___氨水的体积(填“>”“=”或“<”)。
(3)将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同);
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(4)常温时,取0.1 mol·L-1HX溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1 mol·L-1NaOH溶液中由水电离出的c(OH-)之比为________。
②已知NH4X溶液呈中性,又知将HX溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)+H2O(g)![]() H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com