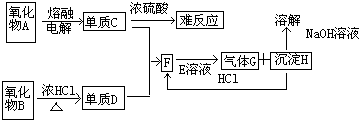
分析:单质C和浓硫酸难反应,可由氧化物电解生成,通常为工业电解氧化铝生成铝的反应,则A为Al2O3,C为Al,沉淀H能溶于NaOH,则应为Al(OH)3,F为AlCl3,D为Cl2,E能与氯化铝反应生成气体和Al(OH)3,应发生互促水解反应,则E可能为NaHCO3,G为CO2,结合对应物质的性质以及题目要求可解答该题.
解答:解:单质C和浓硫酸难反应,可由氧化物电解生成,通常为工业电解氧化铝生成铝的反应,则A为Al
2O
3,C为Al,沉淀H能溶于NaOH,则应为Al(OH)
3,F为AlCl
3,D为Cl
2,E能与氯化铝反应生成气体和Al(OH)
3,应发生互促水解反应,则E可能为NaHCO
3,G为CO
2,
(1)由以上分析可知C为Al,D为Cl
2,G为CO
2,E为NaHCO
3,
故答案为:Al;Cl
2;CO
2;NaHCO
3;
(2)氧化物B+浓HCl的反应为实验室制备氯气的反应,方程式为MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O,
沉淀H+NaOH溶液的反应为Al(OH)
3和NaOH的反应,反应的方程式为Al(OH)
3+NaOH═NaAlO
2+2H
2O,
沉淀H+HCl溶液生成氯化铝和水,反应的方程式为Al(OH)
3+3HCl═AlCl
3+3H
2O,
故答案为:MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O;Al(OH)
3+NaOH═NaAlO
2+2H
2O;Al(OH)
3+3HCl═AlCl
3+3H
2O;
(3)铝在常温下与浓硫酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,可起到保护作用,
故答案为:钝化.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力、推断能力和综合运用元素化合物知识,注意把握题给信息,找出推断的突破口,把握相关物质的性质以及离子方程式、化学方程式的书写,难度中等.