
| A. | ③⑤ | B. | ⑤⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
科目:高中化学 来源: 题型:解答题
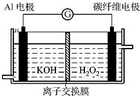 铝、铁和铜是生产、生活中应用最广泛的金属材料.
铝、铁和铜是生产、生活中应用最广泛的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
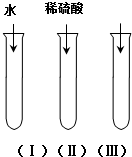 氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.
氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 | |
| B. | 小苏打可中和胃酸,热纯碱溶液可除油污;小苏打和纯碱可以用石灰水鉴别 | |
| C. | 用丁达尔效应区别鸡蛋白溶液和食盐水 | |
| D. | “84消毒液”和洁厕剂能同时使用,除污垢效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体、浓硫酸、胆矾 | B. | 金刚石、石灰石、铁矿石 | ||
| C. | 天然气、碱式碳酸铜、液氧 | D. | 石墨、熟石灰、水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
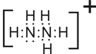
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com