
分析 (1)加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸;
(2)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰;
(3)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$.
解答 解:(1)滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2、I2、6H2O、2、10HCl;
(2)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,
故答案为:MnSO4;
(3)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.8×1{0}^{-10}}$=4.7×10-7,
故答案为:4.7×10-7.
点评 本题考查氧化还原反应、溶度积的有关计算,题目难度不大,侧重于考查学生对基础知识的应用能力和计算能力,注意把握氧化还原反应原理和溶度积常数的计算方法.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中A、B、C、D、E、F、G均为有机化合物.
如图中A、B、C、D、E、F、G均为有机化合物. ;反应①的反应类型是水解反应;
;反应①的反应类型是水解反应; 中任意一种.
中任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
.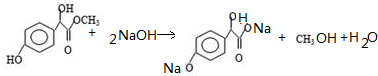 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是形成酸雨的主要物质 | |
| B. | CO2导致温室效应,是一种大气污染物 | |
| C. | CO2(g)+C(s)$\stackrel{高温}{?}$2CO(g)△H>0,高温有利于该反应自发进行 | |
| D. | 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com