
| A. | 常温常压下,28gCH2=CH2含有NA个碳原子 | |
| B. | 1mol苯含有3NA个碳碳单键和3NA个碳碳双键 | |
| C. | 标准状况下,22.4L正戊烷含有12NA个氢原子 | |
| D. | 常温常压下,16gCH4含有4NA个共价键 |
科目:高中化学 来源: 题型:解答题
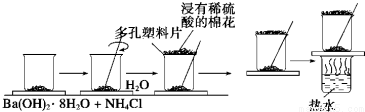
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=C(CH2CH3)C (CH3)3 | B. | CH2=C(CH3)C(CH3)2CH2CH3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
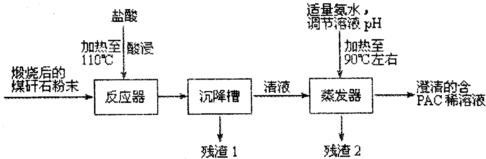
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
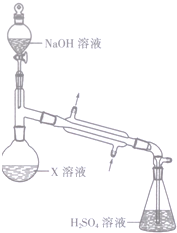 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水中加入生石灰,若保持温度不变,则pH不变 | |
| B. | 升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 | |
| C. | 饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 | |
| D. | 向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,Z的体积分数增大 | |
| B. | 增大压强(缩小容器体积),平衡不移动,Z的浓度不变 | |
| C. | 若平衡体系中共有amol气体,再加入amol的X(g),达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持容器体积不变,充入一定量的Z,达到新平衡时,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com