
下列关于右图所示转化关系(X代表卤素)的说法错误的是
A.2H(g)+2X(g)=2HX(g) ΔH3<0
B.ΔH1=ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量
按Cl、Br、I的顺序依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl
比HBr稳定
科目:高中化学 来源: 题型:
已知:CH3—CH===CH2+HBr—→CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后可以得到8 mol CO2和 4 mol H2O。该烃A在不同条件下能发生如下图所示的一系列变化。

(1)A的化学式:________,A的结构简式:________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C、D、E、H物质的结构简式:
C____________________,D________________________________________________________________________,
E____________________,H________________________________________________________________________。
(4)写出D—→F反应的化学方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 | 结论 | |
| A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.05molCaO | 溶液中 |
| C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
| D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学---物质结构与性质]
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为______________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( )
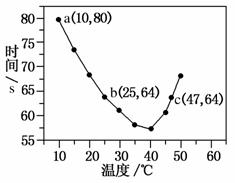
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为
5. 0×10-5 mol·L-1·s1-
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol·L1NaHC2O4溶液与0.1mol·L1KOH溶液等体积混合,所得溶液中:
c(Na)>c(K)>c(C2O42)>c(OH)>c(HC2O4)
B.20mL 0.1 mol·L1NH4Cl溶液与10mL 0.1mol·L1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl)>c(NH4+)>c(Na)>c(OH)>c(H)
C.常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:
c(Na)+c(OH)>c(H)+c(F)
D.0.1mol·L1NH3·H2O溶液与0.1mol·L1HNO3等体积混合,所得溶液中:
c(H)>c(OH)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰在生产、生活中有广泛应用。
(1)锌—锰碱性电池广泛应用于日常生活。电池的总反应式为
Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
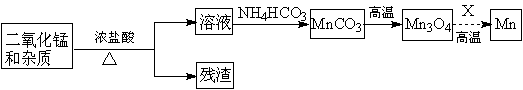
①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
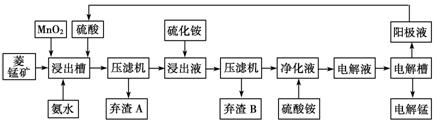
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
①用离子方程式表示加入二氧化锰的作用 。
②加入氨水调节浸出槽中溶液的pH范围: 。
③弃渣B可能含有的物质为 。
④电解槽阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO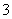 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。
丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是__________________________________ _______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO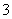 )+c(CO
)+c(CO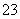 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO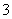 )+c(CO
)+c(CO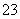 )+c(OH-)
)+c(OH-)
c.HCO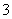 的电离程度大于HCO
的电离程度大于HCO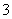 的水解程度
的水解程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com