
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
科目:高中化学 来源: 题型:解答题
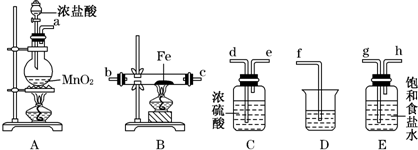
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
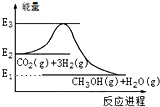
| A. | E2_E1是该反应的热效应 | |
| B. | E3_E1是该反应的热效应 | |
| C. | 该反应放热,在常温常压下就能进行 | |
| D. | 实现变废为宝,且有效控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②⑤ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
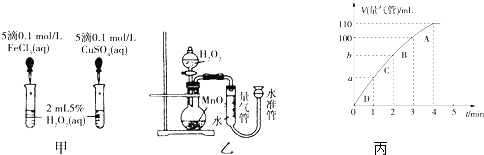
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
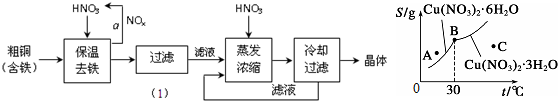
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
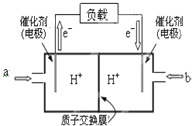 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com