
����Ŀ����1��3-����ϩ���嵥��1��1�ӳ�ʱ���䷴Ӧ�����������仯���£�
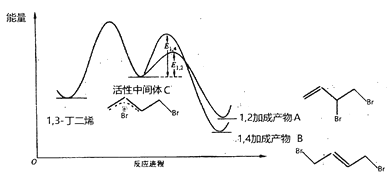
��ͬ��Ӧ�����£�������ͬʱ����������������±���
���������������
A. ����A��B��Ϊͬ���칹�壬���м�������A��B�ķ�Ӧ���ྺ��
B. ��ͬ�������ɻ����м���C���ɲ���A�����ʸ���
C. ʵ��1�ⶨ�������ʱ����ϵ����ƽ��״̬
D. ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B
���𰸡�C
����������������1��3-����ϩ���嵥��1��1�ӳ�ʱ�ķ�Ӧ�����������仯ʾ��ͼ��֪���÷�Ӧ�������ɻ�Ϊͬ���칹������ֲ���A��B�����м�������A��B�ķ�Ӧ���ྺ�������м�������A�Ļ�ܽϵͣ�����ͬ�������ɻ����м���C���ɲ���A�����ʸ�����ʵ��1�ⶨ�������ʱ�����ж���ϵ����ƽ��״̬����ͼ���֪����C����A��B�ķ�Ӧ��Ϊ���ȷ�Ӧ���ɱ������ݿ�֪���ڽϸߵ��¶��£�Cת��ΪB�о������ƣ���ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B��
��⣺A. ����A��B��Ϊͬ���칹�壬���м�������A��B�ķ�Ӧ���ྺ����A��ȷ��
B. ���м�������A�Ļ�ܽϵͣ�����ͬ�������ɻ����м���C���ɲ���A�����ʸ�����B��ȷ��
C. ʵ��1�ⶨ�������ʱ�����ж���ϵ����ƽ��״̬��C��������
D. ��ͼ���֪����C����A��B�ķ�Ӧ��Ϊ���ȷ�Ӧ���ɱ������ݿ�֪���ڽϸߵ��¶��£�Cת��ΪB�о������ƣ���ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B��D��ȷ��
������������������������C������ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A2On2���ɽ�B2������ΪB���ʣ�A2On2����ԭΪA3+ �� ��֪100mL��0.3mol/L��A2On2����150mL��0.6mol/L B2��ǡ����ȫ��Ӧ����A2On2���е�nֵΪ��������
A.4
B.5
C.6
D.7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ���ʾ����ϸ����Ԫ�ء������a��b��c��d������ͬ��С�������ʣ�A��B��C������ͬ�Ĵ�������ʣ�������ش��������⣺
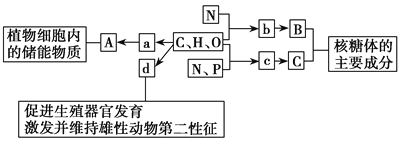
��1������a��_________���ڶ���ϸ���ڣ�������A�����������������_________��������A�ڶ��ֲ��ϸ���о��ɺ��У�������Ϊϸ����������Ĵ������ʣ���������������������С����A��______________��
��2������b��____________����ij��B������n��b���ӣ�ƽ����Է�������Ϊm����ɵ�2������ɣ����B���ӵ���Է���������ԼΪ____________��
��3������c������ϸ���й���_______�֣�������___________�IJ�ͬ������c�����ͬ��
��4������d��____________��d��__________��ά����D�����ڹ̴������ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��M ��Ϊ������Ԫ�ء�25��ʱ��������������Ӧ��ˮ���Ũ�Ⱦ�Ϊ0.01mol/L����Һ��pH��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
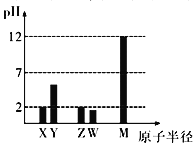
A. X��M �����Ӱ뾶��С˳��X>M
B. X��Y��Z��W��M ����Ԫ����ֻ��һ���ǽ���Ԫ��
C. Z �����������Ļ�ѧʽΪZO3
D. X��Z�������̬�⻯�ﷴӦ�а�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¹ʴ���������ȷ����
A.���߶�·ʧ��ʱ���ô�����ˮ���
B.NaOHŨ��Һ����Ƥ����������ˮ��ϴ��Ȼ��Ϳ��ϡ������Һ
C.Ũ���ὦ��Ƥ���ϣ�������ϡ NaOH ��Һϴ��
D.���Ż�ʱ��������ˮ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���˵����ȷ����
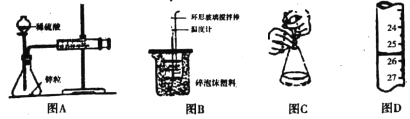
A. ͼA�вⶨп����1mol/Lϡ����ķ�Ӧ���ʣ�ֻ��ⶨע�������ռ����������
B. ͼBװ���н���50mL0.50mol/L������50mL 0.55mol/L NaOH��Һ�����кͷ�Ӧ�ų������IJⶨ��ʹ�¶ȼ��¶����ߵ����������кͷ�Ӧ����1molˮ������
C. ͼC����к͵ζ��У������ڵζ�������������ˮ��ϴ��ƿ�ڱ�
D. ͼD�ζ�����Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ26.50mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�Ǻϳ�ʳƷ���װ���Ͼ���ϩ�ĵ��壬�����ɶ����ѽ��Ʊ���
����Ӧ��C4H10(g,������)![]() C2H4(g)+C2H6(g) ��H1
C2H4(g)+C2H6(g) ��H1
����Ӧ��C4H10 (g,������)![]() CH4(g)+C3H6(g) ��H2
CH4(g)+C3H6(g) ��H2
�ش��������⣺
��1����ѧ�ϣ����ȶ����ʵ�������Ϊ0�������ȶ�������ʱ�ͷŻ����յ��������������ȣ������ȿɱ�ʾ����������������±�Ϊ25�桢101kPa�¼����л���������ȣ�
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ��mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
����д�Ȼ�ѧ����ʽʱ��Ҫ������ͬ���칹�����ơ�����������_______________________��
��������Ӧ�У���H1=______kJ/mol��
��2��һ���¶��£��ں����ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
��������������÷�Ӧ�ﵽƽ��״̬����_______������ţ���
A�������ܶȱ��ֲ��� B��[c(C2H4)��c(C2H6)]/ c(C4H10)���ֲ���
C����Ӧ�Ȳ��� D��������ֽ����ʺ����������������
��Ϊ��ͬʱ��߷�Ӧ���ʺ�ת���ʣ��ɲ��õĴ�ʩ��________________��
��3�����ܱ������г��붡�飬��һ��������Ũ�ȡ�������ѹǿ��)�·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ���¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����__________�������)��
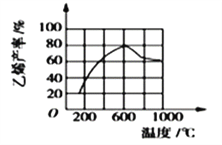
A��ƽ�ⳣ������ B����ܽ���
C���������Խ��� D������������
��4����һ���¶�����1L�����ܱ������г���2mol�����飬��Ӧ������ϩ�����飬����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����
��0~10min����ϩ����������v(C2H4)Ϊ________mol��L-1��min-1��
�����������£��÷�Ӧ��ƽ�ⳣ��KΪ____________��
��5������-����ȼ�ϵ�������ڵ�K2CO3Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�صĸ�����ӦʽΪ______________________________��
��6��K2CO3���ɶ�����̼������������Һ��Ӧ�Ƶá�������,��1 L pH=10��KOH��Һ�г���ͨ��CO2,ͨ��CO2�����(V)����Һ��ˮ�������OH-Ũ�ȵĹ�ϵ��ͼ��ʾ��C����Һ�и�����Ũ�ȴ�С��ϵΪ_________________________________________��
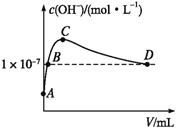
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ��Cu2+��Mn2+��Fe2+��Zn2+�����ֽ�������(M2+)�γ������������S2-���Ũ�ȵĶ���ֵlgc(S2-)��lgc(M2+)�Ĺ�ϵ��ͼ��ʾ�������й��жϲ���ȷ����
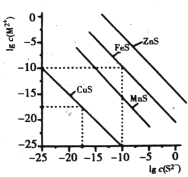
A. ���¶��£�Ksp(MnS)����1.0��10-15
B. ���¶��£��ܽ�ȣ�CuS>MnS>FeS>ZnS
C. ��Mn2+��Zn2+��ϡ��Һ�еμ�Na2S��Һ��Mn2+���п����ȳ���
D. ��c(Fe2+)=0.1mol/L����Һ�м���CuS��ĩ����FeS��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ��Ȼ�����Һ ��39%���Ҵ���Һ ���Ȼ��ƺ͵������ˮ��Һ���������ϸ����Һ����ȷ����������( )
A. ��Һ��������ȡ B. ��ȡ����������Һ
C. ��Һ����ȡ������ D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com