
【题目】已知反应![]() 为放热反应,对该反应的下列说法中正确的( )
为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.因该反应为放热反应,故不必加热就可发生
C.Y的能量一定高于N
D.X和Y的总能量一定高于M和N的总能量
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Li通常保存在煤油中,以隔绝空气
B.碱金属阳离子,氧化性最强的是Li+
C.卤素单质与水反应均可用X2+H2O![]() HXO+HX表示
HXO+HX表示
D.从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
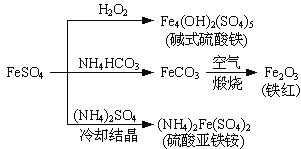
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气和烧碱等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
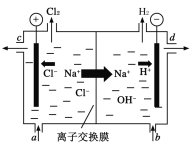
(1)电解饱和食盐水的离子方程式为___。
(2)氢氧化钠溶液从图中___(填“a”、“b”、“c”或“d”)位置流出。
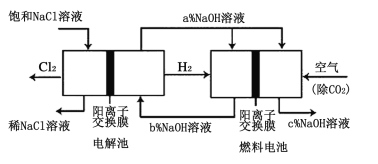
(3)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。通入氢气的电极的电极反应式为___,燃料电池中阳离子的移动方向___(“从左向右”或“从右向左”)。电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为___。a、b、c的大小关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
⑴写出上述反应的化学方程式______
⑵NaH2PO2为______![]() 填“正盐”或“酸式盐”
填“正盐”或“酸式盐”![]()
⑶已知NaH2PO2水溶液pH > 7,次磷酸的电离方程式为______;NaH2PO2水溶液pH > 7的原因:______。
⑷H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______![]() 填化学式
填化学式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是___(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
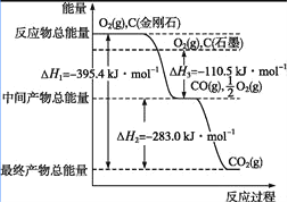
①在通常状况下,金刚石和石墨中___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为___。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为___。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1。
N2(g)+O2(g)=2NO(g)ΔH=+180.0 kJ·mol1。
NO分子中化学键的键能为___ kJ·mol1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法是工业规模海水提溴的常用方法,流程如下:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
下列说法错误的是
A.①中发生的主要反应为Cl2+2Br-=Br2+2Cl-
B.物质X为HBrO
C.②③的目的是富集溴元素
D.空气吹出法利用了溴易挥发的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法错误的是
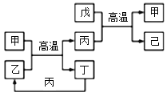
A.W的原子序数是 Z 的两倍,金属性强于Z
B.W元素在周期表中的位置是第四周期VIII族
C.己属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的数值。下列说法正确的是
A.用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
B.28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个
C.0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA
D.常温下,0.1mol·L-1的碳酸钠溶液中含有的阴离子数大于0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com