
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
分析 A、标况下,四氯化碳为液态;
B、根据n=$\frac{m}{M}$计算物质的量,根据N=nNA计算分子个数,根据分子组成计算原子个数;
C、氢气所处的状态不明确;
D、溶液体积不明确.
解答 解:A、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算物质的量,故A错误;
B、氨气的物质的量n=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,一个氨气分子中含有4各原子,则17gNH3含有的原子数为4NA,故B正确;
C、氢气所处的状态不明确,不一定是标况,故物质的量不一定是0.1mol,故转移的电子不一定是0.2mol,故C错误;
D、溶液体积不明确,不能计算出钠离子的个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中通入等物质的量的Cl2:2I-+Cl2═2Cl-+I2 | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 向NaHSO4溶液中加入Ba(OH)2至中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向AgCl饱和溶液中滴加Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(固) | B. | NaCl溶液 | C. | KNO3溶液 | D. | CuSO4(固) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
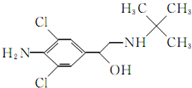 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
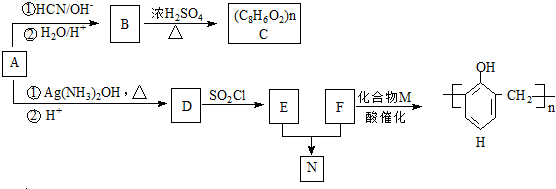
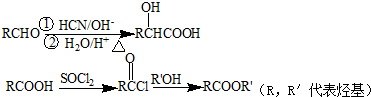 (R,R′代表烃基)
(R,R′代表烃基)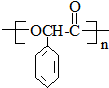 ,M的结构式
,M的结构式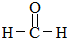 .
. .
.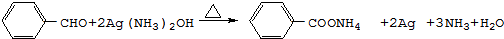 .
.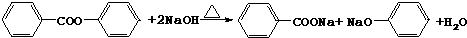 .
.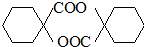 ,其它无机试剂任选.
,其它无机试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
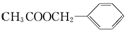 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.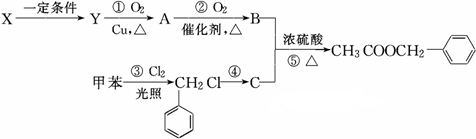
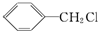 发生反应④的化学方程式为
发生反应④的化学方程式为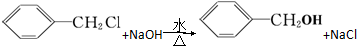 ,该反应的反应类型为水解反应.
,该反应的反应类型为水解反应.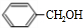 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$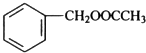 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com