
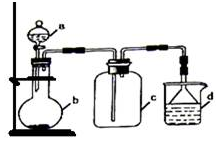
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 由实验装置可知,为固体与液体反应不加热制备气体,且气体的密度比空气密度大,为向上排空气法收集,尾气处理说明气体有毒或污染环境,不能排放在空气中,以此来解答.
解答 解:A.氨气的密度比空气密度下,应利用向下排空气法收集,故A不选;
B.浓硫酸与亚硫酸钠不加热反应生成二氧化硫,气体的密度比空气密度大,利用向上排空气法收集,且有毒,污染环境,利用NaOH溶液吸收尾气,故B选;
C.Cu与稀硝酸反应生成NO,且NO不能利用排空气法收集,故C不选;
D.浓盐酸与二氧化锰反应需要加热,故D不选;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、气体的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液除去乙烷中混有的乙烯,从而得到纯净的乙烷气体 | |
| B. | 向溴水中加入一定量的CCl4并振荡,静置后出现分层现象,上层为橙红色溶液 | |
| C. | 除去乙酸乙酯中的乙醇和乙酸可以用烧碱溶液 | |
| D. | 油脂属于酯类物质,地沟油可用于生产肥皂或生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
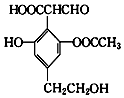
| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 该物质可与H2反应,1mol该物质最多消耗5mol H2 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 | |
| B. | 二氧化硫能使品红褪色,加热后颜色不能恢复 | |
| C. | 二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性 | |
| D. | 二氧化硫属于碱性氧化物,可以用NaOH溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 当钢铁表面水膜呈弱酸性或中性时,主要发生吸氧腐蚀正极反应为:O2-4e-+2H2O=4OH- | |
| C. | 在钢铁设施上连接比铁活泼的金属可防止钢铁腐蚀 | |
| D. | 巨型的铁制桥梁一般采用涂油漆的方法来防生锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com