
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+��NH4+��Cl����Mg2+��Ba2+��CO32����SO42������ȡ���ݸ�100mL����Һ��������ʵ�飺
����һ�ݼ���AgNO3��Һ�г���������
���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�������0.08mol��
�������ݼ�����BaCl2��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g����������ʵ�飬�ش��������⣺
��1���ɵڶ��ݽ��е�ʵ���֪�������Ӧ����___________���ӣ������ʵ���Ũ��Ϊ________��
��2���ɵ����ݽ��е�ʵ���֪12.54�˳����ijɷ���______________��д������ѧʽ���������ʵ����ֱ�Ϊ______________________��
��3��ԭ��Һ���Ƿ����K+_______��ǡ�����������K+��Ũ�ȵ�ȡֵ��Χ��____________________���������ڴ˿տɲ��
���𰸡�NH4+ 0.8 mol/L BaCO3��BaSO4 0.04 mol �� 0.02 mol �� �� 0.4 mol/L
��������
�������������һ����Һ����![]() ��Һ�г����������Ƶÿ��ܺ���
��Һ�г����������Ƶÿ��ܺ���![]() ���ڶ�����Һ������
���ڶ�����Һ������![]() ��Һ���Ⱥ��ռ������壬�Ƶ�һ������
��Һ���Ⱥ��ռ������壬�Ƶ�һ������![]() ��һ��������
��һ��������![]() ����������Һ���÷��������ӷ�Ӧ���������㡢�Ƶ�һ������
����������Һ���÷��������ӷ�Ӧ���������㡢�Ƶ�һ������![]() ��һ��������
��һ��������![]() ��������Һ���������ӵĵ���غ㣬�����Ƴ�
��������Һ���������ӵĵ���غ㣬�����Ƴ�![]() һ�����ڡ�
һ�����ڡ�
��1����������![]() ��Һ���Ⱥ��ռ�������0.08mol���壬����Ϊ����������Һ�к���0.08mol
��Һ���Ⱥ��ռ�������0.08mol���壬����Ϊ����������Һ�к���0.08mol![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��
��2��������![]() ��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g����֪��������
��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g����֪��������![]() Ҳ����
Ҳ����![]() ��
��![]() ����Ϊ4.66g�����ʵ���Ϊ��
����Ϊ4.66g�����ʵ���Ϊ��![]() ��̼�ᱵ����Ϊ��
��̼�ᱵ����Ϊ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��0.04 mol ��0.02 mol��
��0.04 mol ��0.02 mol��
��3������������������Һ�п϶�����![]() ��
��![]() ���϶�������
���϶�������![]() ��
��![]() �����ܴ���
�����ܴ���![]() ������
������![]() �����ʵ���Ϊ0.04 mol ��0.02 mol��
�����ʵ���Ϊ0.04 mol ��0.02 mol��![]() ���ʵ���Ϊ0.08mol�����ݵ���غ㣬����
���ʵ���Ϊ0.08mol�����ݵ���غ㣬����![]() ��
��![]() �����ʵ���Ϊ0.04mol��������
�����ʵ���Ϊ0.04mol��������![]() ��
��![]() �����ʵ��������0.04mol���ʿ϶�����
�����ʵ��������0.04mol���ʿ϶�����![]() �������ʵ���Ũ�ȴ��ڵ���
�������ʵ���Ũ�ȴ��ڵ���![]() ��
��
�ʴ�Ϊ���� ���� 0.4 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Թ�ѧ��������Ϣ�����⼼����ҽ�ơ����������������ҪӦ�ü�ֵ���ҹ���ѧ������Ca2CO3�� XO2��X= Si��Ge����H3BO3�״κϳ������ΪCsXB3O7�ķ����Թ�ѧ���塣�ش��������⣺
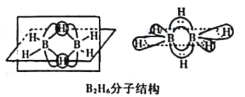
(1)��̬��ԭ�ӵļ۵����Ų�ͼ��____________��������ͬ���ڵķǽ�������Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ________________��
(2)B�ļ��⻯��BH3������������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ____________________��
�ڰ����飨NH3BH3������Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����______________��д��һ���백���黥Ϊ�ȵ�����ķ���_________�������ʽ����
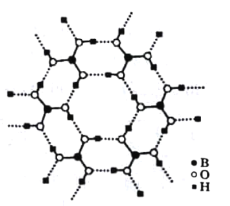
(3)��ͼΪH3BO3�����Ƭ��ṹ������B���ӻ���ʽΪ_______����������ˮ�б�����ˮ���ܽ�������������Ҫԭ����____________��

(4)�Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã���Ϊԭ�ӷ������ꡣCsSiB3O7����������ϵ���������Σ�����������Ϊanm��bnm��cnm����ͼΪ��y��ͶӰ�ľ���������Csԭ�ӵķֲ�ͼ��ԭ�ӷ������ꡣ�ݴ��ƶϸþ�����Csԭ�ӵ���ĿΪ_________��CsSiB3O7��Ħ������ΪMg��mol��1����NAΪ�����ӵ�������ֵ����CsSiB3O7������ܶ�Ϊ_____g��cm��3���ú���ĸ�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ�����������ʵ�飬��ͼ����ʾ��

��1��ֻ����ͼ����ʾʵ�飬�ܹ��ﵽʵ��Ŀ���ǣ�����ţ�___________��
��2��ͼ����ʾʵ����ܼ������������ʣ���ʵ�����ȣ�ʵ������ŵ�_____________��
��3������ʵ�����֤̼���ƺ�̼�����Ƶ��ȶ��ԣ����Թ�B��װ��Ĺ��������_______��
��4��������ƿ��Һ����֪�ֱ���K2CO3��NaHCO3������д�����ֲ�ͬ�ļ�����
��_____________________________����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¾ɶ���ת������֮һ������Դ�²��ϵ��ھ��Ӧ�á��Ҷ�������Ҫ�Ļ���ԭ�ϣ� ú���ϳ���(CO�� H2)������Ҷ�������ת���ʸߡ������ʸߵ��ŵ㣬���ҹ�һ��ӵ������֪ʶ��Ȩ�������״��������Ʊ��������£�
��Ӧ I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) ��H1 = a kJ��mol-1
4CH3ONO(g)+2H2O(g) ��H1 = a kJ��mol-1
��Ӧ II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) ��H2= b kJ��mol-1
CH3OOCCOOCH3(l) + 2NO(g) ��H2= b kJ��mol-1
��Ӧ III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) ��H3= c kJ��mol-1
HOCH2CH2OH(1)+2CH3OH(g) ��H3= c kJ��mol-1
��1����д��ú���ϳ���[n(CO): n(H2)= 1:2]��������Ӻϳ��Ҷ�����HOCH2CH2OH�������Ȼ�ѧ����ʽ��________________________________________���÷�Ӧ�ڽϵ������������Է����У�����H______0 (������������������������)��
��2��һ���¶��£��� 2 L ���ܱ�������Ͷ�����ʵ�����Ϊ 0.4mol��CO �� CH3ONO������Ӧ II��10min �ﵽƽ��ʱCO�����������NO�����������ȡ�
������ѡ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����________��
a. ������������ʵ������ٱ仯
b. ���������ܶȲ��ٱ仯
c. ��λʱ�������� CO �� NO �����ʵ������
d. CO �� CH3ONO ��Ũ�ȱȲ��ٱ仯
������ʱ����������ͨ��0.4 mol NO��һ��ʱ��ﵽ��ƽ��ʱ NO�����������ԭƽ��ʱ���______(���������������������С����������ȷ����)��
�����÷�Ӧ��H��0���ں��ݵ��ܱ������У���Ӧ��ƽ��ı�ijһ����������ʾ��ͼ��ȷ����____________������ĸ����

����Ӧ��ƽ�����2 L�����ܱ��������ټ��� 0.4mol��CO �� 0.4mol NO����ѧƽ����________����������Ӧ�������淴Ӧ������ƽ�ⲻ�ƶ����������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У���������������ԭ�����͵���
A.��ˮӦ�ܱձ��棬�����ڵ��´�
B.��2HI(g) ![]() H2(g)+I2(g)ƽ����ϵ������ƽ����ϵ��ѹǿ��ʹ������ɫ����
H2(g)+I2(g)ƽ����ϵ������ƽ����ϵ��ѹǿ��ʹ������ɫ����
C.��������Ĺ�����ʹ�ù�����������߰�����������
D.��ˮ��������ƽ��Br2+H2O![]() HBr+HBrO��������AgNO3��Һ����Һ��ɫ��dz
HBr+HBrO��������AgNO3��Һ����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�������������ش�п����м�����渽��пƤ���������⼰���ۣ��кܶ���;��ij�����ۺ����ö�п����м�Ĺ�������ͼ����ش�

��1��������������Һ���ݷ���м��Ŀ����_________��
��2���������������ʺϳ䵱������A����_______�����ţ���
A�� KMnO4 B�� Cl2 C��H2O2 D�� HNO3
��3���ۺ������� ��ˮ��������Ҫ�����������ۺϸ�����Ҫ������ˮ���������ۺ����������̣���ˮ����ʱ��Ӧ�Ļ�ѧ����ʽΪ__���ۺϸ�����Һ��pH���������һ���ķ�Χ�ڣ�pHƫСFe3+ˮ��̶�����pHƫ����__������ڳ�ѹ��������ѹ�������ŵ���__��
��ˮ��������Ҫ�����������ۺϸ�����Ҫ������ˮ���������ۺ����������̣���ˮ����ʱ��Ӧ�Ļ�ѧ����ʽΪ__���ۺϸ�����Һ��pH���������һ���ķ�Χ�ڣ�pHƫСFe3+ˮ��̶�����pHƫ����__������ڳ�ѹ��������ѹ�������ŵ���__��
��4������Fe3O4�������ڸ���ʯīϩ���ϵ����ܡ��Ƶ���ҺBʱ�����������A��������ԭ����_____��
��5������мҲ�����������������ۣ����������ܹ�ȥ������ˮ�е�NO3-����Ӧ�����ӷ���ʽΪ4Fe+NO3-+10H+=4Fe2++NH4++3H2O���о����֣���pHƫ�ͽ��ᵼ��NO3-��ȥ�����½�����ԭ����__����ͬ�����£���������ȥ����ͬˮ����NO3-�������нϴ���죨����ͼ���������ò���Ŀ���ԭ����___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯����(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��

�������Ϲ����жϣ����н�����ȷ���ǣ� ��
A.��Ӧ����H��0��p2��p1B.��Ӧ����H��0��T1��T2
C.��Ӧ����H��0��T2��T1����H��0��T2��T1D.��Ӧ������H��0��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T�������£���1L�̶�������ܱ�����M�м���2molX��1molY���������·�Ӧ��2X(g)��Y(g)![]() a Z(g)��W(g) ��H����890kJ��mol��1(aΪ������)��
a Z(g)��W(g) ��H����890kJ��mol��1(a������)��
����Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
��1����ѧ������a��ֵΪ_____��
��2���¶�ά��T �治�䣬����ʼʱ������M�м���4molX��6molY�����ﵽƽ��ʱ�����ڵ�ѹǿ��С��10%����Ӧ�зų�������Ϊ___kJ��
��3���¶�ά��T �治�䣬����һ����ԭ���������ȵĺ�ѹ����N�У�����2molX��1 molY�������Ϸ�Ӧ����ƽ�⣬��������X����������M___N(ѡ�������������)��
��4����֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯�����
�¶�/�� | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
����ij�¶��£�2molX��1molY������M�з�Ӧ��ƽ�⣬ X��ƽ��ת����Ϊ50%������¶�Ϊ_____�档ƽ��ʱ X���������Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H = - 49.0 kJmol-1����3�����ݵ��ܱ������зֱ�Ͷ�����ʵ�����Ϊ 3��4 ��CO2��H2��H2�����ʵ���(mol)��ʱ��(min)�仯���±�(T��ʾ�¶�)������˵����ȷ����
CH3OH(g)+H2O(g) ��H = - 49.0 kJmol-1����3�����ݵ��ܱ������зֱ�Ͷ�����ʵ�����Ϊ 3��4 ��CO2��H2��H2�����ʵ���(mol)��ʱ��(min)�仯���±�(T��ʾ�¶�)������˵����ȷ����

A.�ڵ�I����0~8 min��CO2��ƽ����Ӧ����Ϊ2 mol��L-1��min-1���ҷų�98 kJ����
B.��I���10 min���£��ٳ���1 mol CO2(g)��3 mol H2O(g)����v ��<v ��
C.3 minʱ������T2�����Ե�II���ѹʹ�����С2 L�����´�ƽ�������Ũ�����I����ͬ
D.�Աȵ�I�͵�III�飬�� 0~4 min�ڣ���˵��H2��ƽ����Ӧ�������¶����߶�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com