
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g•cm﹣3,则盐酸的物质的量浓度是()
A. 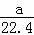 mol•L﹣1 B.
mol•L﹣1 B. 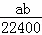 mol•L﹣1
mol•L﹣1
C. 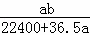 mol•L﹣1 D.
mol•L﹣1 D. 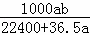 mol•L﹣1
mol•L﹣1
考点: 物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: 根据n= 计算a L HCl的物质的量,根据m=nM计算HCl的质量,溶液的质量=1000g+m(HCl),根据V=
计算a L HCl的物质的量,根据m=nM计算HCl的质量,溶液的质量=1000g+m(HCl),根据V=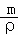 计算溶液的体积,再根据c=
计算溶液的体积,再根据c=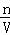 计算所得溶液的物质的量浓度.
计算所得溶液的物质的量浓度.
解答: 解:标准状况下的aL HCl(气)的物质的量为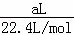 =
=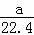 mol.
mol.
氯化氢的质量为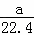 mol×36.5g/mol=
mol×36.5g/mol=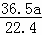 g.
g.
所以溶液质量为1000g+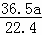 g=(1000+
g=(1000+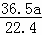 )g.
)g.
所以溶液的体积为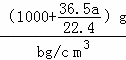 =
=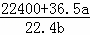 mL.
mL.
所以溶液浓度为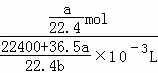 =
=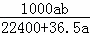 mol/L.
mol/L.
故选D.
点评: 本题考查物质的量浓度的相关计算与理解,难度不大,正确计算溶液的体积是解本题的关键,注意不能把溶剂的体积当做溶液的体积.也可计算质量分数,利用c=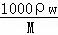 计算.
计算.


科目:高中化学 来源: 题型:
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和8体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)()
A. 乙炔 B. 丙炔 C. 2﹣戊炔 D. 1,3﹣丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是()
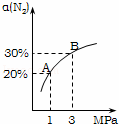
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 平衡状态由A变到B时,平衡常数K(A)<K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是()
A. CuCl2[CuSO4] B. NaOH[NaOH] C. NaCl[HCl] D. CuSO4[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中数据合理的是()
A. 用10mL量筒量取5.2mL盐酸
B. 用pH试纸测得某溶液的pH值为12.5
C. 用托盘天平称取25.12gNaCl固体
D. 用100mL容量瓶配制50mL0.1mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是()
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
9.75g锌与0.3 mol的盐酸刚好完全反应,放出0.15 mol H2,在溶液中有0.15mol Zn2+离子和0.3 mol Cl﹣离子,把反应后的溶液蒸干,可以得到ZnCl20.15 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是()
A. 次磷酸的电离方程式为H3PO2⇌3H++PO23﹣
B. 次 磷酸中P的化合价为+1
磷酸中P的化合价为+1
C. NaH2PO2是酸式盐
D. NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com