
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
下列说法比较合理的是( )
|
| A. | 果汁喝起来味美香甜,痛快解渴,因为它的营养成分要比水果含量高 |
|
| B. | 酸性食物和碱性食物主要是根据食物的口感和味觉来识别的 |
|
| C. | 经常从事长跑训练的运动员,应多吃一些含铁丰富的食物,因为这样有利于血红蛋白的合成,维持正常的血红蛋白水平,预防缺铁性贫血 |
|
| D. | 早晨起床后没有胃口,食欲不振,因此早餐可以少吃一些或不吃 |
查看答案和解析>>
科目:高中化学 来源: 题型:

如图,a的金属活动性在氢以前,b为碳棒,关于下列装置的说法中不正确的是( )
A.a极上发生还原反应,b发生氧化反应
B.碳棒上有气体逸出
C.电子流动的方向从a→b
D.反应后a极质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
用图中所示的装置进行实验,实验现象与预测不一致的是
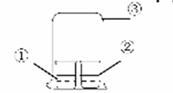
| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
| D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
适用相关化学知识进行判断,下列结论正确的是
A.某吸热反应能自发进行,则该反应的△S>0
B.SO2使酸性KMnO4溶液褪色,因此SO2具有漂白性
C.在物质分离的方法中,蒸馏、萃取、重结晶都与物质的溶解度有关
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能加快生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见物质A、B、C、D、E、X,存在图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 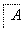





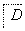
A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
B、若D是一种强碱,则A、B、C均可与X反应生成D
C、若D为NaCl,且A可与C反应生成B,则E可能是CO2
D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH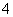 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO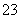 、SO
、SO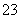 、SO
、SO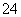 、Cl-、NO
、Cl-、NO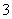 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的数据是破坏1 mol化学键所消耗的能量。
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
根据上述数据回答(1)~(4)题。
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HF B.HCl
C.HBr D.HI
(3)X2+H2===2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:________。
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com