
分析 反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:(1)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价,被氧化,HCl是还原剂,氯气既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
答: ;KClO3;HCl;
;KClO3;HCl;
(2)反应中6molHCl中有5mol被氧化,生成3mol Cl2,则生成标准状况下的Cl2为6.72L即$\frac{6.72L}{22.4mol/L}$=0.3mol,被氧化的HCl为0.5mol,
答:被氧化的HCl的物质的量为0.5mol.
点评 本题考查了物质的量之间计算、离子方程式的书写、氧化还原反应的基本概念,侧重考查学生对基础知识的掌握情况,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+ )+c(M+ )=c(OH- )+c(A- ) | |
| B. | pH 相等的 NaHCO3、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(NaHCO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO- )+2c(OH- )=2c(H+ )+c(CH3COOH) | |
| D. | 0.1mol•L-1 的NaHA溶液,其pH=4:c(HA- )>c(H+ )>c(H2A)>c(A2- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
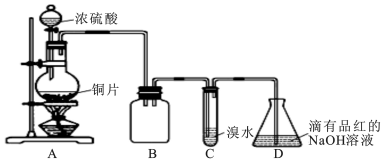
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20 mL3mol/L的x溶液 | B. | 20℃30 mL2mol/L的x溶液 | ||
| C. | 10℃10 mL4mol/L的x溶液 | D. | 10℃20 mL2mol/L的x溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
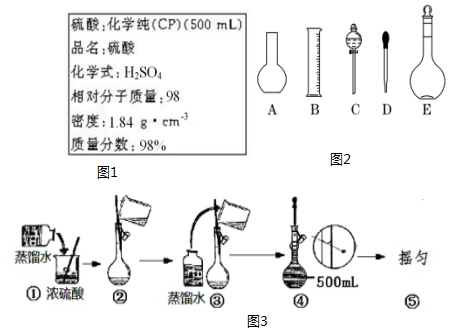
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
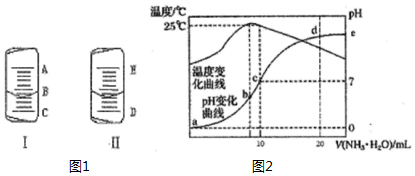 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
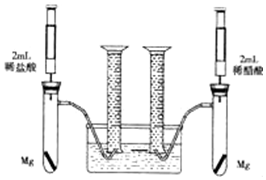 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com