
【题目】活性炭吸附法是工业提碘的主要方法之一,其流程如图:
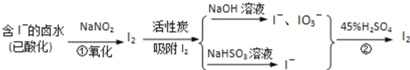
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式______.
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是______.
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是______.
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是______.
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解______和电离______(用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向______移动;加入少量NaClO固体,溶液的pH______(选填:增大、减小、不变).
【答案】2NO2﹣+4H++2I﹣═2NO+I2+2H2O 氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质 碘在水中的溶解度不大,且易升华 富集碘元素 HSO3﹣+H2OH2SO3+OH﹣ HSO3﹣SO32﹣+H+ 逆反应方向 减小
【解析】
(1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为:![]() ;
;
(2)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I选择了价格并不便宜的亚硝酸钠,故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体,解释产生这种现象的原因碘在水中的溶解度不大,且易升华,所以,反应②需要在水浴加热条件下进行,故答案为:碘在水中的溶解度不大,且易升华;
(4)流程中,卤水中碘元素浓度不高,碘元素经过了I2→I、![]() →I2的变化过程,这样反复的目的是富集碘元素,故答案为:富集碘元素;
→I2的变化过程,这样反复的目的是富集碘元素,故答案为:富集碘元素;
(5)①NaHSO3溶液显弱酸性,是因为该溶液中存在以下的平衡:①水![]() 和②电离:
和②电离:![]() ,电离程度大于水解程度;
,电离程度大于水解程度;
②加入Ba(OH)2,OH浓度增大,平衡逆向移动,加入少量NaClO固体,发生氧化还原反应生成硫酸和氯化钠,溶液pH减小,故答案为:逆反应方向;减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ,已知Cu2O(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式:__________________________________.
(2)反应中硝酸体现了____________、__________性质.
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________.
II:现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;请回答下列问题:
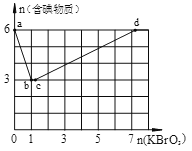
(4)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式______。
(5)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________mol。
(6)n(KBrO3)=4时,对应含碘物质的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl—+HClO
H++Cl—+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-= AgCl↓
A.①②③④⑤B.①②③C.②③D.③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com