
 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.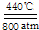 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述). 分析 (1)①根据价层电子对互斥理论确定其杂化类型;
②先利用均摊法计算该晶胞中C原子的数目,再根据ρ=$\frac{m}{V}$来计算;
(2)①根据相似相溶原理确定分子的极性;
②利用均摊法计算;
(3)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②根据甲醛的结构式进行判断,单键为σ键,双键中具有1个σ键、1个π键;分子间存在着氢键,熔、沸点升高;
③根据Cu的电子排布式书写Cu2+离子的电子排布式,判断其最高能层和该能层下的原子轨道数;
④根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(4)根据题意,以二氧化碳和金属钠作原料,在440℃和800atm的条件下,成功合成了金刚石,同时生成碳酸钠,写出反应的化学方程式即可;根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
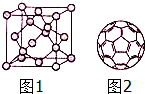
解答 解:(1)金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化;
故答案为:sp3;
②该晶胞中C为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,该晶胞中立方体的长为apm,则体积为a3×10-30cm3,金刚石的密度为=$\frac{\frac{12}{{N}_{A}}×8}{{a}^{3}×10{\;}^{-30}}$g•cm-3=$\frac{96}{{a}^{3×}1{0}^{-30}×N{\;}_{A}}$g•cm-3
故答案为:$\frac{96}{{a}^{3×}1{0}^{-30}×N{\;}_{A}}$;
(2)①苯、CS2都是非极性分子,根据相似相溶原理知,C60是非极性分子,属于分子晶体;
故答案为:分子;
②利用均摊法知,每个碳原子含有$\frac{1}{2}$×3=$\frac{3}{2}$个σ 键,所以1mol C60分子中,含有σ 键数目=$\frac{3}{2}$×1mol×60×NA/mol=90NA;
故答案为:90NA;
(3)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O;
故答案为:C≡O;
②甲醛的结构式为 ,分子中含有2个C-H键、1个C=O键,单键为σ键,双键中具有1个σ键、1π键,故分子中σ键和π键数目比为3:1;
,分子中含有2个C-H键、1个C=O键,单键为σ键,双键中具有1个σ键、1π键,故分子中σ键和π键数目比为3:1;
甲醇分子间存在着氢键,沸点升高,甲醛分子间没有氢键;
故答案为:3:1;甲醇分子之间可以形成氢键;
③Cu2+的质子数为29,原子核外电子数为28,故电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
故答案为:M;9;
④锰元素为25号元素,原子核外有25个电子,所以核外电子排布式为:1s22s22p63s23p63d54s2;
答案为:1s22s22p63s23p63d54s2;
(4)以二氧化碳和金属钠作原料,在440℃和800atm的条件下,成功合成了金刚石,同时生成碳酸钠,反应的化学方程式为:4Na+3CO2 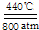 2Na2CO3+C;CO32-中C原子的价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,杂化轨道数3,采用原子杂化方式是sp2,为平面三角形结构,
2Na2CO3+C;CO32-中C原子的价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,杂化轨道数3,采用原子杂化方式是sp2,为平面三角形结构,
故答案为:4Na+3CO2 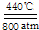 2Na2CO3+C;平面正三角形.
2Na2CO3+C;平面正三角形.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断以及晶胞计算等知识点,熟练掌握基础知识并灵活运用基础知识解答问题是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
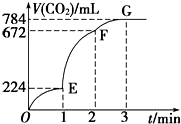 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )| A. | OE段表示的平均速率最快 | |
| B. | EF段,用盐酸表示该反应的平均反应速率为0.4 mol•L-1•min-1 | |
| C. | OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 | |
| D. | F点收集到的CO2的量最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④
④ ⑤
⑤ ⑥
⑥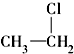 ⑦
⑦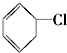 ⑧
⑧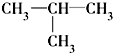 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)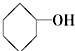 (11)
(11)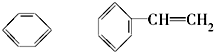 ⑫CH3Cl
⑫CH3Cl
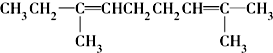 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com